超高效液相色譜-串聯質譜法同時測定小麥中4種真菌毒素
2021-10-12 13:58:27 來源: 世界杯賽程預測 導刊
超高效液相色譜-串聯質譜法同時測定小麥中
4種真菌毒素
胡 莎1,袁 夢1,葛文靜1,林翠蘋2,於業誌3
(1.青島市糧油質量檢測和軍隊糧油供應中心,山東青島 266000;2.青島市食品藥品檢驗研究院,山東青島 266000;
3.青島菲優特檢測有限公司,山東青島 266000)
作者簡介:胡莎(1988—),女,江西進賢人,碩士,工程師。研究方向:糧油檢測。
作者簡介:胡莎(1988—),女,江西進賢人,碩士,工程師。研究方向:糧油檢測。
摘 要:本文旨在建立同時測定小麥中脫氧雪腐鐮刀菌烯醇、玉米赤黴烯酮、黃曲黴毒素B1和赭曲黴毒素A 4種真菌毒素的超高效液相色譜-串聯質譜的分析方法。以小麥為研究對象,分樣製粉後,經乙腈/水振蕩提取後過濾,濾液中加入乙酸混勻,通過MycoSpinTM400多功能淨化柱,以1%乙酸溶液+5 mmol/L乙酸銨水溶液-甲醇為流動相,多反應監測模式上機檢測。結果顯示,4種真菌毒素在各自的濃度範圍內均有良好的線性關係(r2≥0.996 2),3水平加標回收率在86.6%~110.1%,相對標準偏差在3.0%~18.7%,具有良好的精密度。該方法具有靈敏度高、準確、高效的優點,適用於小麥中4種真菌毒素同時前處理檢測。
關鍵詞:超高效液相色譜-串聯質譜;小麥;真菌毒素
真菌毒素汙染是威脅糧食安全的重要因素,糧食在種植、加工、儲存及流通等環節中可能被真菌毒素汙染[1],最新發布的《
世界杯賽程預測國家標準 食品中真菌毒素限量》(GB 2761—2017)規定了穀物及其製品中對黃曲黴毒素B1(Aflatoxin B1,AFT B1)、脫氧雪腐鐮刀菌烯醇(Deoxynivalenol,DON)、赭曲黴毒素A(Orchatoxin A,OTA)及玉米赤黴烯酮(Zearalenone,ZEN)的限量指標[2-3],這4種真菌毒素是目前為止認為可能對人們的健康構成較大風險的[3-7]。現在國內外對糧油產品中真菌毒素的檢測標準方法一般常見的有膠體金快速檢測法[8-9]、薄層色譜法[10]、酶聯免疫法[11]、高效液相色譜法[12]及液相液質聯用法[13]。
本文旨在建立多功能柱淨化、超高效液相色譜-串聯質譜法同時測定小麥中DON、OTA、AFT B1和ZEN共4種真菌毒素的含量。
1 材料與方法
1.1 儀器與試劑
Agilent超高效液相色譜串聯質譜聯用儀(UPLC-QQQ 1290-6460,安捷倫科技有限公司);離心機(Sartorius sigma 3-18k)振蕩器(Heidolph Multi Reax);電子天平(Sartorius);MycoSpinTM 400 Multitoxin淨化柱(Romer Labs公司);微型聚四氟乙烯濾膜(0.22 μm)。
超純水(娃哈哈);乙腈(色譜純)、乙酸(色譜純)、乙酸銨(色譜純)、甲醇(色譜純),德國merck公司;標準溶液DON(100.6 mg/L)、ZEN(100.4 mg/L)、AFT B1(100.3 mg/L)、OTA(100.1 mg/L),Pribolab公司。
1.2 實驗方法
1.2.1 樣品處理
稱取25 g(精確至0.001 g)樣品於250 mL具塞三角瓶中,加入100 mL乙腈/水(50/50,V/V),放置於震蕩器中混合90 min,靜置1 min後過濾,吸取10 mL濾液於50 mL聚丙烯離心管中,並加入500 μL乙酸混勻,從混合液中移取750 μL至MycoSpinTM 400淨化柱,蓋緊淨化柱振蕩混合
1 min,淨化柱底端將淨化柱放入離心管中,轉速10 000 r/min離心30 s,取上清液過0.22 μm濾膜於進樣瓶中,待上機檢測。
1.2.2 溶液的配製
(1)混合標準工作液的配製。將4種真菌毒素標準溶液依次稀釋成DON(100 μg/mL)、ZEN(100 μg/mL)、
AFT B1(4.0 μg/mL)、OTA(2 μg/mL)的單標儲備液,分別吸取1 500 μL、200 μL、250 μL、1 000 μL的DON、ZEN、OTA、AFT B1單標儲備液於10 mL容量瓶中,用水定容至刻度,配製成濃度分別為15.0 μg/mL、2.0 μg/mL、0.1 μg/mL、0.2 μg/mL的混合標準工作液。
(2)標準溶液配製。分別準確移取25 μL、50 μL、
100 μL、250 μL、500 μL和1 000 μL混標溶液於10 mL容量瓶中,用標準曲線溶劑(乙腈-水-乙酸混合液35.0︰64.5︰0.5,體積比)定容至刻度,各標準具體濃度見表1。
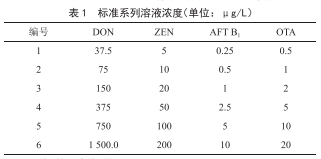
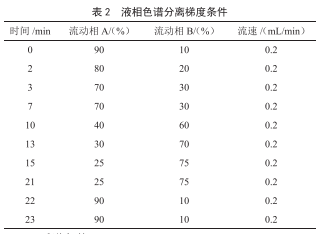
1.2.3 色譜分離條件
色譜柱C18柱(1.8 μm,100 mm×3.0 mm);柱溫:35 ℃;進樣體積:4 μL;流動相A:1%乙酸溶液+5 mmol/L乙酸銨水溶液;流動相B:甲醇,流動相梯度見表2。
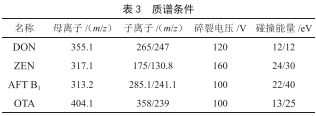
1.2.4 質譜條件
離子源:電噴霧離子源;毛細管電壓:4 kV(+)3.5 kV(-);幹燥氣溫度:350 ℃;霧化氣電壓:40 psi;幹燥氣流量:10 L/min;碰撞氣:氮氣;掃描模式:多反應監測MRM;駐留時間:30 ms;
2 結果與分析
2.1 液相色譜條件的優化
2.1.1 流動相的優化
流動相對檢出目標物質的分離度、響應值、峰型及離子化效率都有影響,根據現有的檢測這4種毒素的檢測標準及相關文獻顯示流動相一般采用甲酸水溶液/乙腈,乙腈/乙酸銨,乙腈/甲酸/甲酸銨,乙腈/水,乙酸銨/甲醇-乙腈,結合需檢出的這4種真菌毒素的結構特性,一般在ESI正負離子模式下[M+H]+、[M-H]-、[M-CH3COO]-、[M+NH4]+離子峰形式出現,本實驗選定流動相為1%乙酸溶液+5 mmol/L乙酸銨水溶液/甲醇對4種真菌毒素能夠有很好的分離效果。
2.1.2 色譜柱的優化
本實驗比較了兩種色譜柱Eclispse Plus C18(2.1mm×50 mm,1.8 μm)和ZORBAX Eclipse Plus C18(3.0 mm×100 mm,1.8 μm)對4種真菌毒素的分離效果,同樣的色譜條件下後一種色譜柱分離效果更佳。
2.2 質譜條件的優化
2.2.1 母離子的選擇和碎裂電壓的優化
將真菌毒素單標溶液直接連接質譜進樣1 μL,分別在正負離子模式下進行MS2 Scan全掃描,確定各毒素母離子質量數。然後進行MS2 SIM選擇離子監測,優化碎裂
電壓。
2.2.2 子離子的選擇和碰撞能量的優化
設置母離子質量數和MS2的掃描範圍,進行Product Ion Scan 子離子掃描,將響應最高的確定為定量離子,次之確定為定性離子,並優化碰撞能量CE。優化完成後進行MRM多反應監測,主要參數見表3。

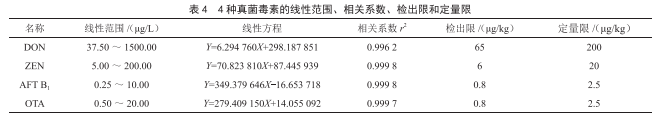
2.3 線性範圍與檢出限
由表4可知,4種真菌毒素在標準曲線溶液濃度範圍內有較好的線性關係,以3倍和10倍信噪比分別確定目標物的檢出限和定量限。
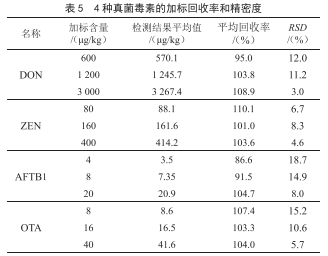
2.4 回收率與精密度
在空白樣品中添加低、中、高3個不同濃度的混合標準溶液,3水平重複測定6次,加標回收率、相對標準偏差結果見表5。3水平加標回收率在86.6%~110.1%,相對標準偏差在3.0%~18.7%,由此可見,方法具有良好的精
密度。

3 結論
本文采用乙腈水提取小麥中4種常見真菌毒素,MycoSpinTM400 Multitoxin 淨化柱淨化,能有效的去除小麥基質中的雜質,減少基質效應,采用三重四極杆液質聯用MRM模式進行檢測,該方法高效快捷、操作簡單、回收率高,精密度與準確度好,適合同時測定小麥中4種真菌
毒素。
參考文獻
[1]蘇福榮,王鬆雪,孫輝,等.國內外糧食中真菌毒素限量標準製定的現狀與分析[J].糧油食品科技,2007,15(6):57-59.
[2]國家衛生和計劃生育委員會,國家食品藥品監督管理總局.食品中真菌毒素限量:GB 2761—2017[S].北京:中國標準出版社,2017.
[3]DRAGAN R M,MARIJA Š,TATJANA B.Real and perceived risks for mycotoxin contamination in foods and feeds:challenges for food safety control[J].Toxins,2010,2(4):572-592.
[4]BLAKE R R,MUSTAFA I S.Aflatoxin B1:A review on metabolism,toxicity,occurrence in food,occupational exposure, and detoxification methods[J].Food and Chemical Toxicology,2018,124:81-100.
[5]ANNIE P,RICHARD A M.Ochratoxin A:An overview on toxicity and carcinogenicity in animals and humans[J].Molecular Nutrition and Food Research,2007,51(9):1192.
[6]JAMES J P.Deoxynivalenol:mechanisms of action,human exposure,and toxicological relevance[J].Archives of Toxicology,2010,84(9):663-679.
[7]KAROLINA K,DOMINIKA E,AGNIESZKA W.Zearalenone as an endocrine disruptor in humans[J].Environmental Toxicology and Pharmacology,2016,48:141-149.
[8]曹德康,蘇建忠,張瑛,等.膠體金免疫層析技術快速檢測穀物中3種真菌毒素的研究[J].中國
食品衛生雜誌,2017,29(3):306-312.
[9]陳明偉,王岩,張永君,等.糧食中真菌毒素和快速定量檢測方法的探討[J].糧食與食品工業,2020,27(4):69-71.
[10]馮莉.薄層色譜法檢測玉米中黃曲黴毒素B1[J].現代畜牧科技,2018(8):24.
[11]劉菲,王莉娜,胡俊.酶聯免疫吸附篩法測定大米和大麥中黃曲黴毒素B1的含量[J].2018,6(69):14-18.
[12]BASCARÁN V,ROJAS D,CHOUCIÑO P,et al.Analysis of ochratoxin A in milk after direct immunoaffinity column clean-up by high-performance liquid chromatograp-by with fluorescence detection[J].Journal of chromatography A,2007,1167(1):95-101.
[13]朱芸,雒婉霞,趙清榮,等.液質聯用同位素內標法同時測定3類小麥終產品中4種B類單端孢烯黴族類真菌毒素[J].中國衛生檢驗雜誌,2017,27(13):1863-1866.
熱點推薦
- 2022世界杯预选赛
-

全球食品創新平台第五期已啟動,攜手共創安全、健康、綠色的未來
-
特醫食品不是藥,卻是臨床治療的關鍵支撐
- 世界杯2022赛程时间表最新
-

全十紅紅稗餅幹|中秋團圓,回家必備
-
超高效液相色譜-串聯質譜法同時測定小麥中4種真菌毒素
-

關於微生物法測定米粉中維生素B6含量不確定度評估
-

加強食品質量監督檢驗數據真實性和有效性的路徑
-

食品微生物檢測方法及質量控製對策探究
-
大學生世界杯賽程預測 關注度及相關知識認知調查
-

食品檢驗在保障世界杯賽程預測 中的重要性探究
-
大型超市食品零售的經營模式與質量管理研究
-

生物傳感快速檢測技術的探討
-

淺談我國餐飲產業鏈中央廚房中預製菜
-
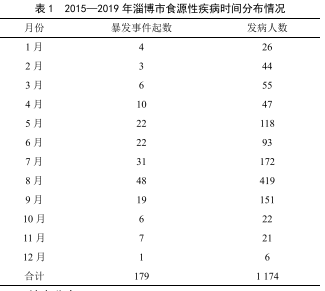
淄博市2015—2019年食源性疾病暴發事件流行病學特征分析
-
“世界杯賽程預測 學”課程思政教學改革探討
-

烹飪專業實踐教學的學生滿意度調查及改進策略分析
-
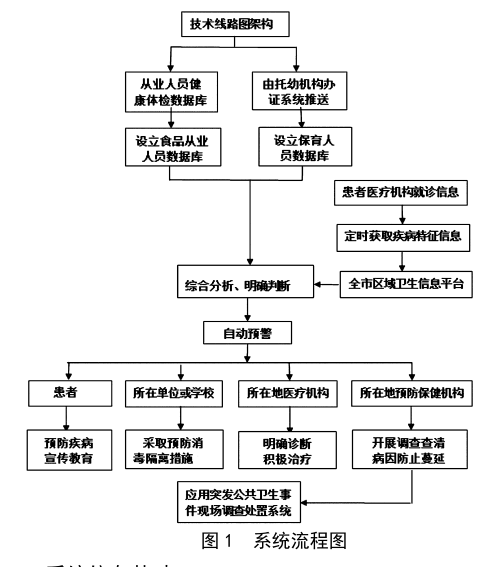
重點人群食源性傳染病監測預警係統研究
-
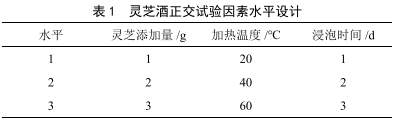
苦瓜靈芝酒的研製
-
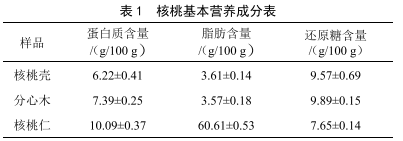
溫宿薄皮核桃營養品質的研究
-
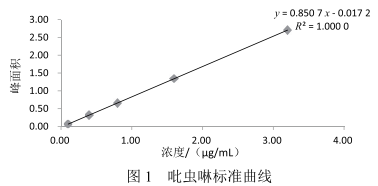
高效液相色譜法測定花椒中吡蟲啉的殘留量
-
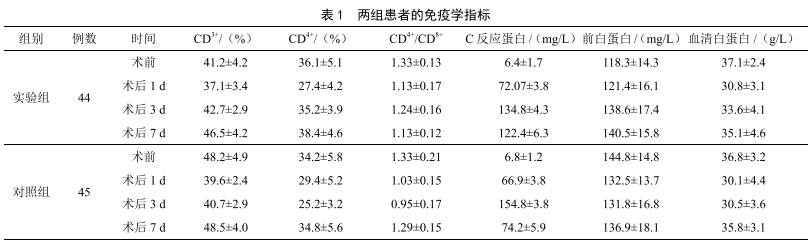
早期腸內營養對結腸癌患者術後免疫功能和康複的影響
-
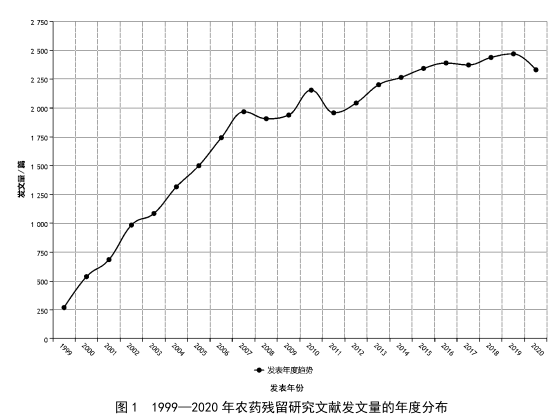
基於文獻計量分析農藥殘留檢測技術研究進展
-
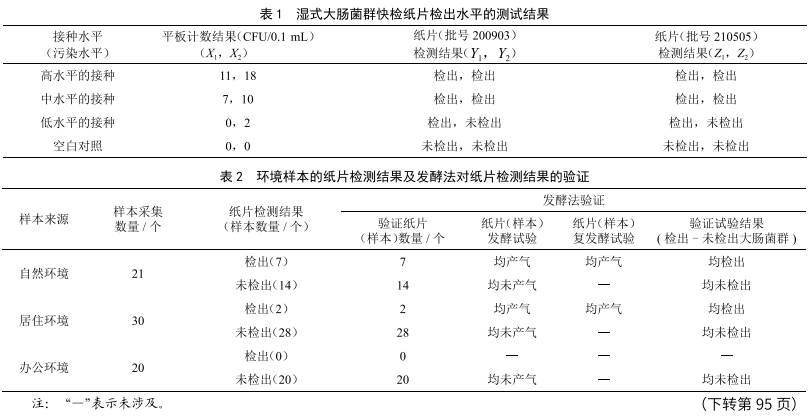
濕式大腸菌群快檢紙片性能驗證的方法探索
-
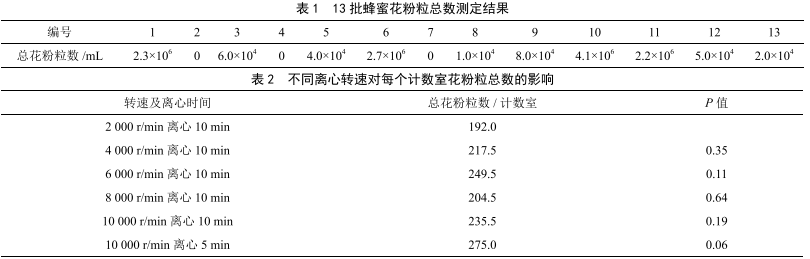
市售蜂蜜中花粉粒總數測定
-

2020年陽江市江城區生活飲用水溶解性總固體和總硬度指標分析
-
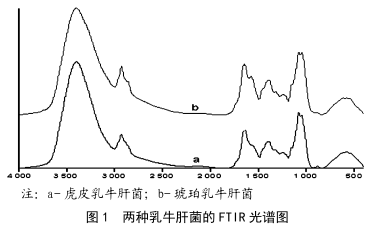
牛肝菌的紅外光譜分析
-

基於高效液相色譜法蔬果中滅多威及異丙威的
-
不同方法檢測食源性致病菌的對比研究
-
醬醃菜中亞硝酸鹽含量的測定





