生薑蛋白酶基因的克隆及在原核細胞中的表達
2021-08-30 14:33:38 來源: 世界杯賽程預測 導刊
生薑蛋白酶基因的克隆及在原核細胞中的表達
盧 瑛
(萊蕪職業技術學院,山東萊蕪 271100)
基金項目:萊蕪職業技術學院2015年度教師科研項目“生薑蛋白酶純化工藝的開發”(2015jsky12)。
摘 要:提取萊蕪生薑總RNA,采用RT-PCR技術擴增出生薑蛋白酶(Ginger protease)基因GP2和GP3,經序列比對,發現萊蕪生薑蛋白酶基因GP2在945位的堿基與Gene bank中生薑蛋白酶的序列GP2b(GI:57118006)有差異,GP3在451、700和804這3個位置的堿基與GP3b(GI:57118011)有差異,在翻譯後的氨基酸也不同,表明了不同生薑品種生薑蛋白酶基因的多樣性。將克隆的GP2片段GPII重組到帶有His-tag的原核表達載體pET30a(+)中,構建重組表達載體pET-GPII。將重組pET-GPII轉化到大腸杆菌BL21(DE3)中構建工程菌株,工程菌株用異丙基-β-D-硫代半乳糖苷(IPTG)誘導表達,在誘導6 h,IPTG濃度為0.1 mmol/L時,重組GPII表達量最高。SDS-PAGE凝膠電泳分析結果表明蛋白大小約為21 kDa。該實驗結果表明生薑蛋白酶能夠在原核表達係統進行大量表達,為生薑蛋白酶工程化生產奠定了基礎。
關鍵詞:萊蕪生薑;生薑蛋白酶;克隆;原核細胞;表達
生薑蛋白酶(Ginger protease/Zingibain,EC 3.4.22.67)是存在於生薑塊狀根莖中的一種巰基蛋白酶,有兩種GP-I和GP-II(GPI和GPII分別與GenBank中GP3和GP2同源性較高),均含有221個氨基酸,含有6個Cys形成3個二硫鍵為糖蛋白,具有蛋白水解活性。生薑蛋白酶能夠水解膠原蛋白,可用於肉類嫩化、酒類澄清,乳製品凝固等[1],以薑汁為添加劑開發的具有新型保健功能的凝固型酸奶,在廣東地區頗受歡迎,因此該酶具有良好的工業化應用前景[2]。
生薑蛋白酶的分離純化工藝操作複雜,而且生薑蛋白酶的含量在不同生薑品種、不同栽培地區及不同氣候條件下差異非常大,甚至同一品種的幹薑與生薑之間的含量也不相同,導致生薑蛋白酶的提取率不穩定[3]。尤其生薑常年連作導致莖腐病、斑點病和薑瘟病高發,推升了市場上生薑的價格,使得提取生薑蛋白酶的成本升高,進一步限製了生薑蛋白酶的開發利用。
本實驗從萊蕪生薑中提取總RNA,通過RT-PCR技術擴增生薑蛋白酶基因,並構建了pET-GPII原核表達載體,重組質粒在大腸杆菌BL21中實現了原核表達,為生薑蛋白酶工程化生產進行了探索。
1 材料與方法
1.1 實驗材料
1.1.1 菌種、質粒和植物材料
大腸杆菌DHB4和宿主菌BL21以及質粒pET30a(+)為本實驗室保存,萊蕪生薑購於萊蕪大潤發超市。
1.1.2 酶、試劑盒和生化試劑
dNTP、DL2000、EasyTaq DNA聚合酶、TransStart FastPfu DNA聚合酶購自北京全式金生物技術有限公司;植物總RNA提取試劑盒購自北京康為世紀有限公司;T4 DNA連接酶購自TaKaRa公司;限製性內切酶KpnI、XbaI、EcoRI和反轉錄試劑盒RevertAid Fist Strand cDNA Synthesis Kit購自ThermoFisher公司;DNA凝膠回收試劑盒和DNA質粒提取試劑盒購自OMGEA公司。
1.2 實驗方法
1.2.1 生薑蛋白酶cDNA的合成
根據植物總RNA提取試劑盒操作說明分離提取生薑總RNA,將RNA利用反轉錄試劑盒合成cDNA並稀釋至
50 ng/µL。
1.2.2 引物的設計與合成
根據Gen Bank(NCBI)數據庫中生薑半胱氨酸蛋白酶基因GP2a(GI:57118005)和GP3a(GI:57118009)的上下遊序列設計特異性引物,以生薑mRNA反轉錄產物(cDNA)為模板,PCR克隆生薑蛋白酶基因。兩對特異性引物,分別為GP2a上遊引物:5’-ATTAGGATCCATGGCTTCCACCGTAGACAAT-3’,下遊引物:5’-ATTAAAGCTTTGCACTGCTCTTGAGACCTCC-3’;GP3a上遊引物:5’-ATTTGGATCCATGGCTTCCTTCGTCGC-3’,下遊引物:5’-ATTAGTCGACTGCACTGCTCTTCAGACC-3’;GPII上遊引物:5’-ATTAGAATTCGCTCCCTATCAGGATGTCCTGA-3’,下遊引物:5’-ATTATCTAGATGCACTGCTCTTGAGACCTCC-3’。
1.2.3 生薑蛋白酶原核表達載體的構建
以稀釋後的cDNA為模板,PCR擴增生薑蛋白酶基因。PCR反應程序按照TransStart FastPfu DNA聚合酶說明書執行。產物經1%瓊脂糖凝膠電泳分離並回收目的片段。將回收的PCR產物交由上海桑尼生物科技有限公司進行測序,並與Gene Bank上已發布的序列進行比對。以GP2序列為模板克隆GPII片段,並連接到表達載體pET30a(+)載體上轉化感受態DHB4,經Kan+抗性的LB固體培養基篩選。挑取抗性重組子測序,將序列正確的克隆命名為pET-GPII。提取重組質粒轉化BL21感受態細胞。
1.2.4 生薑蛋白酶表達條件優化
將攜帶重組表達載體pET-GPII的工程菌BL21在LB培養基上培養至OD600為0.4時,分別加入0~0.5 mmol/L不同濃度的IPTG,37 ℃誘導4 h,並通過SDS電泳分析IPTG濃度對誘導結果的差異。進一步在加入0.1 mmol/L的IPTG條件下誘導0~10 h不等的時間,分析不同誘導時間對誘導結果的差異。
2 結果與分析
2.1 生薑蛋白酶基因的克隆與原核表達載體構建
通過RT-PCR成功獲得與目的基因大小相符的DNA片段。將該片段連接到原核表達載體pET-30a(+)並進行測序,GP2序列全長為1 146 bp,GP3為1 401 bp。序列比對發現與GP2與GP2b(GI:57118006)同源性為99.91%,僅在945位堿基發生改變,與GP2a(GI:57118005)相同位置的堿基一致。GP3與GP3b(GI:57118011)同源性為94.77%,有451、700和804這3個位置的堿基發生改變,與GP3a(GI:57118009)相同位置上的堿基一樣(如圖1所示),說明了不同品種生薑蛋白酶基因的多樣性。進一步以GP2為模板,克隆出了726 bp的GPII片段[4],並將其連接到原核表達載體pET-30a(+)構建重組表達載
體pET-GPII。
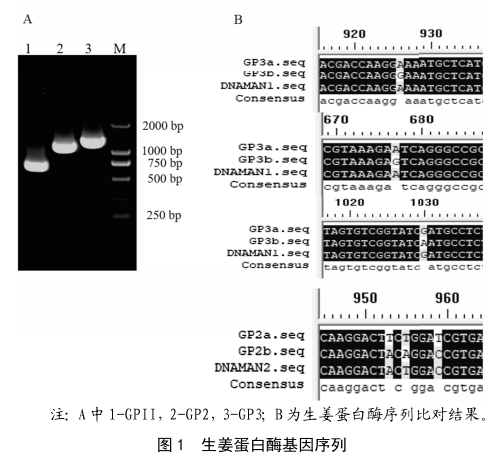
注:A中1-GPII,2-GP2,3-GP3;B為生薑蛋白酶序列比對結果。
圖1 生薑蛋白酶基因序列
2.2 生薑蛋白酶的誘導表達及誘導條件優化
將重組表達載體pET-GPII轉化宿主菌BL21,培養單克隆菌落至OD600=0.4,然後添加IPTG,濃度為0.05 mmol/L,發酵1 h,4 h,6 h和10 h,以未添加IPTG的pET-GPII的菌和轉化空載體的菌為對照組,結果發現當誘導時間達到
6 h以後,目的基因的蛋白表達量沒有顯著變化(圖2A)。當加入不同濃度的IPTG時,發現0.1 mmol/L的IPTG誘導表達的蛋白量最多(圖2B);因此推斷最佳誘導條件為37 ℃,0.1 mmol/L,IPTG誘導6 h。
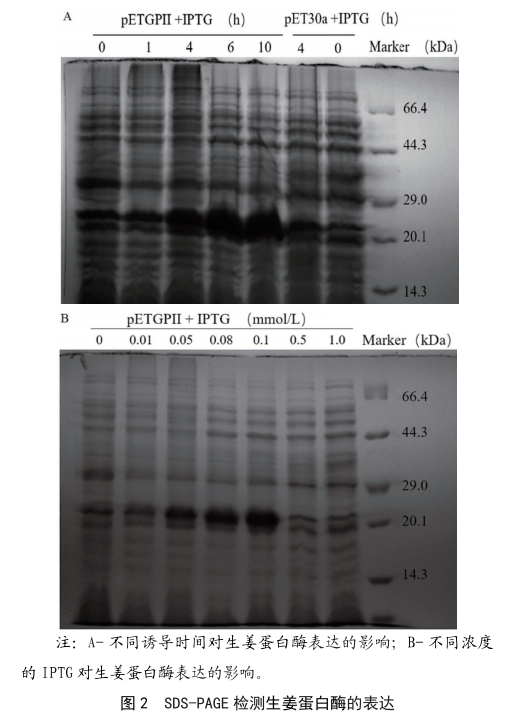
注:A-不同誘導時間對生薑蛋白酶表達的影響;B-不同濃度的IPTG對生薑蛋白酶表達的影響。
圖2 SDS-PAGE檢測生薑蛋白酶的表達
3 結論與討論
近年來隨著對生薑蛋白酶的深入研究,發現生薑蛋白酶對肉類具有良好的嫩化作用,對於酒類的澄清效率遠高於木瓜蛋白酶,還可作為凝乳劑來製作風味乳品。用生薑蛋白酶製備的奶酪,口感好,無苦澀感[5-6],說明生薑蛋白酶具有潛在的商業應用價值。
原核表達係統具有遺傳背景清晰,細胞生長周期短,增殖速度快,發酵產量高,易於工程化等優點而受到歡迎,而且優化發酵條件可以使目的蛋白以可溶的形式生產。本研究成功克隆了生薑蛋白酶基因,並在原核表達係統中成功誘導表達,在37 ℃,0.1 mmol/L IPTG誘導條件下表達6 h產量最高。這為生薑蛋白酶工程化生產提供了理論基礎。
參考文獻
[1]馮敏,唐春紅.生薑蛋白酶的研究概述[J].中國食品添加劑,2008(6):58-60.
[2]李田葉,李旻,安建樂,等.響應麵法優化生薑蛋白酶提取及酸奶中的應用[J].食品工業,2015,36(7):91-95.
[3]代景泉,黃雪鬆.生薑蛋白酶的分離純化[J].食品科學,2003(2):73-79.
[4]MISOOK Kim,Hamilton S E.,Guddat L W.,et al.Plant collagenase:Unique collagenolytic activity of cysteine proteases from ginger[J].2007,1770(12):1627-1635.
[5]黃冬香,李小華,李林,等.生薑蛋白酶的研究進展及其在
食品加工中的應用[J].食品工業科技,2009,30(12):406-409.
[6]範金波,侯宇,黃訓文,等.生薑蛋白酶的分離、純化及酶學性質研究[J].食品與發酵工業,2014,40(5):65-69.
熱點推薦
-
特醫食品不是藥,卻是臨床治療的關鍵支撐
- 世界杯2022赛程时间表最新
-

全十紅紅稗餅幹|中秋團圓,回家必備
-

和汪氏蜂蜜共同來普及蜂蜜結晶現象
-

拿坡海開啟西餐加盟新潮流, 大眾化家庭小西餐成未來新趨勢
-

生薑蛋白酶基因的克隆及在原核細胞中的表達
-
高效液相色譜法測定牛奶中咪唑啉酮類除草劑——滅草煙的含量
-
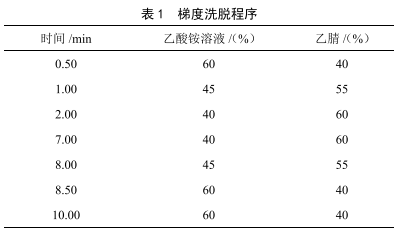
高效液相色譜-串聯質譜法測定蓮菜中
-

2020年慶陽市餐飲服務單位消毒餐飲具大腸菌群分析報告
-

UPLC-MS/MS法測定畜肉中萊克多巴胺
-

2017—2019年煙台經濟技術開發區中小學及托幼機構飲用水調查分析
-

食品鏈中五氯酚酸鈉風險梳理及對策
-

啤酒非生物穩定性及控製簡述
-
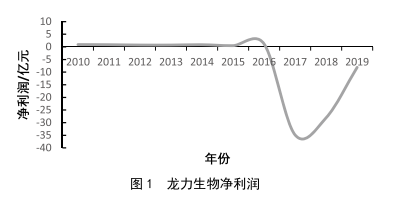
食品企業內部控製風險分析及對策研究 ——以龍力生物為例
-
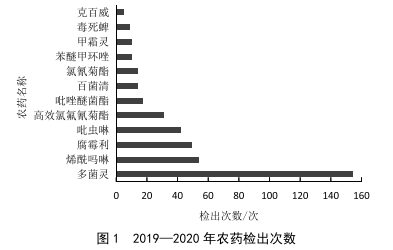
平涼市農產品質量安全現狀及建議
-

珠三角地區肉製品中亞硝酸鹽含量調查分析
-
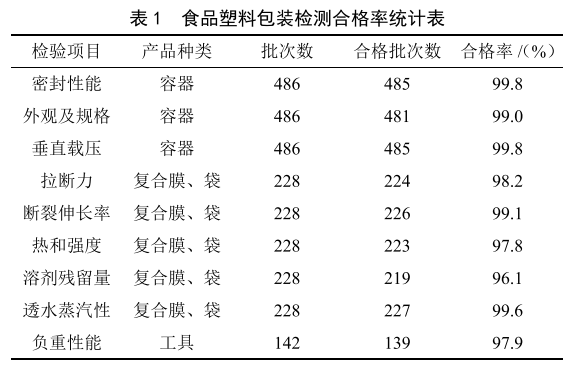
食品用塑料包裝產品質量與世界杯賽程預測
-

冷凍飲品中增稠劑使用情況調查
-
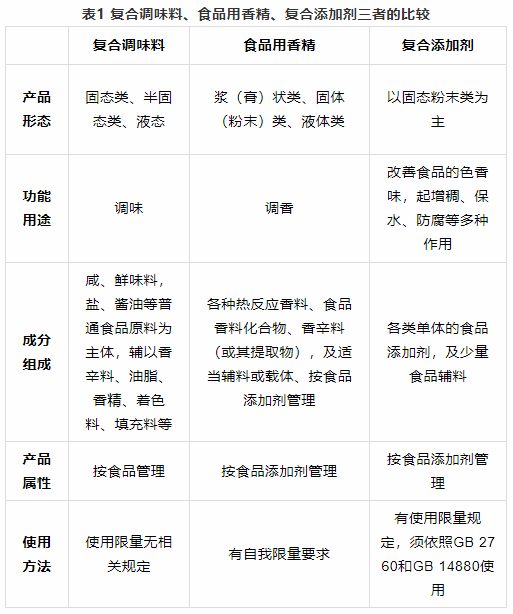
你知道複合調味料、食品用香精與複合食品添加劑的區別嗎?
-
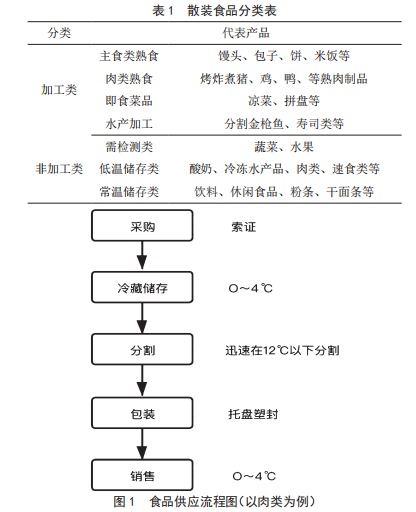
大型超市散裝食品質量管理體係的建立與實踐研究
-
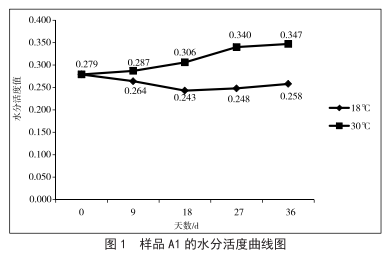
嬰幼兒穀類輔助食品開封後水分活度的變化及安全性評價
-
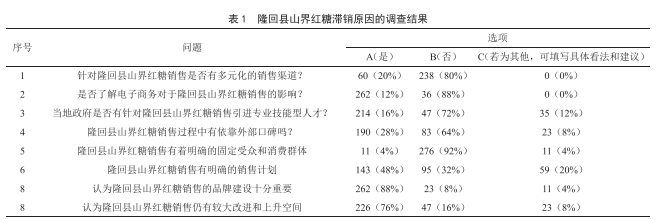
隆回縣山界紅糖滯銷的調查分析與應對建議
-
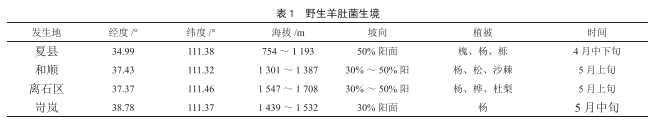
山西部分地區野生羊股菌資源調査
-
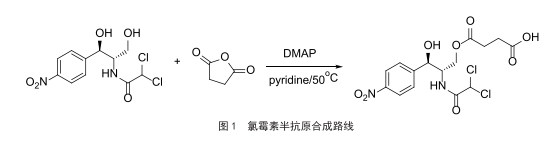
一種氯黴素高靈敏消線法檢測試紙條的製備
-

食品接觸用紙中鄰苯二甲酸酯類 塑化劑的風險管控
-
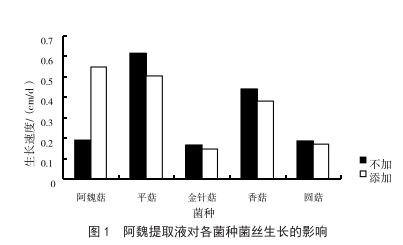
阿魏提取物對傘形食用菌菌絲生長的影響
-
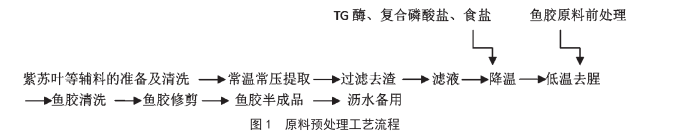
一種即食魚膠的去腥及品質改良的工藝方法
-

磁性改性茶葉渣對鉛離子吸附性能的研究
-
甘露子提取物的不同提取方法及其體外抗氧化活性研究
-

基於模糊數學法綜合評價蘋果汁、杏汁





