金黃色葡萄球菌檢驗技術介紹及分析
2020-06-10 15:59:15 來源: 世界杯賽程預測 導刊
□ 李留洋 銳德檢測技術(天津)有限公司
金黃色葡萄球菌是生活中最常見的病原菌之一,也是革蘭氏陽性菌的代表,可引起許多嚴重的感染。該菌對營養的要求不高,在普通培養基上生長良好,需氧或兼性厭氧。容易受金黃色葡萄球菌汙染的食品主要為乳製品、蛋及蛋製品、各類熟肉製品,其次是含有乳類的冷凍食品等,因此對於該菌的檢驗也被確定為食品致病性菌種檢驗中的重要項目。

圖 1 樣品處理
按照現行的國標方法,金黃色葡萄球菌檢測方法分為第一法定性檢驗、第二法平板計數法(適用於金黃色葡萄球菌含量較高的食品),以及第三法MPN計數法(適用於金黃色葡萄球菌含量較低的食品)。
第一法定性檢驗過程包括樣品處理、樣品增菌、平板分離劃線、初步鑒定、確證鑒定這5個步驟,整個流程全部完成至少需要5天時間。第二法平板計數法包括5個步驟——樣品稀釋、樣品接種塗布、典型菌和可疑菌計數、鑒定試驗、結果計算,整個流程全部完成至少需要4天時間。第三法MPN計數法同樣包括5個步驟,即樣品稀釋、樣品增菌、平板分離劃線、鑒定試驗、查MPN表確認結果,整個流程全部完成至少需要5天時間。以下將對金黃色葡萄球菌的檢測流程進行簡單介紹,並對難點、注意事項進行梳理和講解。
1 第一法:金黃色葡萄球菌定性
1.1 樣品處理
固態和半固態樣品:稱取25g樣品至盛有225mL7.5%氯化鈉肉湯中,充分混勻。
液體樣品:吸取25mL樣品至盛有225mL7.5%氯化鈉肉湯的無菌錐形瓶(瓶內可預置適當數量的無菌玻璃珠)中,振蕩混勻。
1.2 樣品增菌
將上述樣品勻液置於36±1℃的恒溫培養箱中培養18~24h。
1.3 平板分離劃線
該步驟是整個金黃色葡萄球菌檢測環節中最重要的步驟之一,因為平板劃線分離的效果決定了可疑菌落的判定和選擇。平板劃線選擇三分法或四分法則分離效果較好,更容易出現單菌落平板。

圖 2 血平板(左)與 BP 平板(右)
1.4 初步鑒定
分離的培養基選用Baird-Parker平板(BP平板)和血平板。結果顯示,金黃色葡萄球菌在Baird-Parker平板上呈圓形,表麵光滑、凸起、濕潤,菌落直徑為2~3mm,顏色呈灰黑色至黑色、有光澤,常有淺色(非白色)邊緣,周圍繞以不透明圈(沉澱),其外常有一清晰帶,當用接種針觸及菌落時具有黃油樣黏稠感;有時可見到不分解脂肪的菌株——除沒有不透明圈和清晰帶外,其他外觀基本相同;從長期貯存的冷凍或脫水食品中分離的菌落,其顏色常較典型菌落略淺,且外觀可能較為粗糙,質地較幹燥。在血平板上,金黃色葡萄球菌形成的菌落較大,呈圓形、光滑凸起、濕潤、金黃色(有時為白色),菌落周圍可見完全透明的溶血圈。結合兩種培養基的特性即可確定可疑菌落。
1.5 確證鑒定
1.5.1 染色鏡檢
金黃色葡萄球菌為革蘭氏陽性球菌,排列呈葡萄球狀,無芽胞和莢膜,直徑約為0.5~1μm。
1.5.2 血漿凝固酶試驗
挑取Baird-Parker平板或血平板上至少5個可疑菌落(小於5個則全選),分別接種到5mL BHI和營養瓊脂小斜麵,在36±1℃條件下培養18~24h。
購買凍幹兔血漿,按照說明書加入0.5mL無菌生理鹽水溶解,然後加入0.3mL BHI培養物,輕微搖晃至完全溶解或按照說明書直接將0.8mL BHI培養物加入到凍幹兔血漿中輕微搖晃至完全溶解(一般選用後者),置於恒溫培養箱中,每半小時觀察一次凝集情況,連續觀察6h。根據經驗,若金黃色葡萄球菌呈強陽性,一般1~2h就可凝集,有的甚至長達3h才會凝集。需注意,切忌直接放置6h才進行觀察,因為菌種凝固後會發生自溶現象,隔夜自溶是常見的判斷。凝集的最好方法就是倒立觀察結塊,如倒立後內容物不下落,則效果較好。
1.5.3營養瓊脂純化
典型金黃色葡萄球菌在營養瓊脂上一般呈黃色,較容易判斷;有些呈淡色、白色,但不常見。如果認為鑒定結果可疑,可挑取營養瓊脂小斜麵的菌落到5mL BHI,36±1℃培養18~48h,重複試驗。
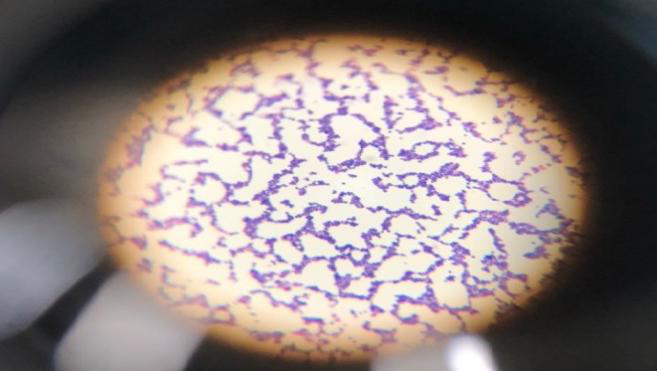
圖 3 鏡檢
2 第二法:平板計數法
2.1 樣品稀釋
固態和半固態樣品:稱取25g樣品至225mL稀釋液中(可選用0.85%的生理鹽水或磷酸鹽緩衝溶液)充分混勻,即為稀釋度10-1溶液,之後進行梯度稀釋。
液體樣品:吸取25mL樣品至盛有225mL7.5%氯化鈉肉湯的無菌錐形瓶(瓶內可預置適當數量的無菌玻璃珠)中,振蕩混勻。
2.2 樣品接種塗布
選擇性平板采用BP平板,該平板可提前一天配製——潔淨台中放置過夜或置於25~50℃培養基中幹燥,直到平板表麵的水珠消失後備用。該步驟的目的是檢查平板是否染菌,最重要的是揮發培養基內部的水分以利於塗布。每個梯度分別吸取1mL樣品勻液,以0.3mL、0.3mL、0.4mL接種量分別接種至3塊BP平板上,然後用無菌塗布棒塗布整個平板。如塗布棒不是一次性的,可以提前滅菌備用,也可用酒精燈灼燒2min以上冷卻備用。塗布時盡量塗幹,注意不要觸及平板邊緣。此後將平板靜置10min,如樣液不易吸收,可將平板放在培養箱36±1℃培養1h。等樣品勻液吸收後翻轉平板,倒置後於36±1℃培養24~48h(倒置培養的目的在於防止與空氣中的細菌交叉汙染,還可防止培養基水分揮發太快),觀察結果。

圖 4 典型菌落、陰性及陽性對照凝集效果
2.3 典型菌和可疑菌計數
從圖5可以看出,10-1稀釋度下菌落生長繁多,難以計數;最適計數範圍為20~200CFU,故10-2稀釋度滿足計數要求,可疑菌總數在適宜計數範圍內;而10-3稀釋度下可疑菌落很少,故舍去。從10-2梯度上可以看出,具有沉澱環的菌落很多,這就需要從這些菌種中選擇5個或以上可疑菌落進行血漿凝固酶試驗,但是這5個菌落該如何選擇才能使最終的結果最接近真實值是需要技巧的。
首先可以觀察到,平板上的可疑菌落沉澱環有兩種:一種是和菌落有些距離的沉澱環,記為可疑菌1——經過後期確認試驗可知此菌為幹擾菌,即表皮葡萄球菌;另一種是從菌落邊緣直接延伸出來的沉澱環,記為可疑菌2。將所有可疑菌1與所有可疑菌2的菌落數出來,可判斷出可疑菌落是兩類不同的細菌。根據兩者的比例,決定挑選可疑菌落數的分配情況,比例大的多選,比例小的少選。

圖 5 不同稀釋度條件下的菌落生長狀態
2.4 鑒定試驗
平板法的鑒定試驗過程及注意事項按第一法的“1.4”“1.5”進行。
2.5 結果計算
①若隻有一個稀釋度平板的典型菌落數在20~200CFU之間,應計數該稀釋度平板上的典型菌落,按式(1)計算;
②若最低稀釋度平板的典型菌落數小於20CFU,應計數該稀釋度平板上的典型菌落,按式(1)計算;
③若某一稀釋度平板的典型菌落數大於200CFU,但下一稀釋度平板上沒有典型菌落,應計數該稀釋度平板上的典型菌落,按式(1)計算;
④若某一稀釋度平板的典型菌落數大於200CFU,而下一稀釋度平板上雖有典型菌落但不在20~200CFU範圍內,應計數該稀釋度平板上的典型菌落,按式(1)計算;
⑤若2個連續稀釋度的平板典型菌落數均在20~200CFU之間,應按式(2)計算。
式(1):
式(1)中,T為樣品中金黃色葡萄球菌菌落數;A為某一稀釋度典型菌落的總數;B為某一稀釋度鑒定為陽性的菌落數;C為某一稀釋度用於鑒定試驗的菌落數;d為稀釋因子。
式(2):
式(2)中,T為樣品中金黃色葡萄球菌菌落數;A1為第一稀釋度(低稀釋倍數)典型菌落的總數;B1為第一稀釋度(低稀釋倍數)鑒定為陽性的菌落數;C1為第一稀釋度(低稀釋倍數)用於鑒定試驗的菌落數;A2為第二稀釋度(高稀釋倍數)典型菌落的總數;B2為第二稀釋度(高稀釋倍數)鑒定為陽性的菌落數;C2為第二稀釋度(高稀釋倍數)用於鑒定試驗的菌落數;1.1為計算係數;d為稀釋因子(第一稀釋度)。
3 第三法:MPN計數法
3.1 樣品稀釋
按照“2.1”進行。
3.2 樣品增菌
根據對樣品汙染狀況的估計,選擇3個適宜稀釋度的樣品勻液(液體樣品可包括原液),在進行10倍遞增稀釋的同時,每個稀釋度分別接種1mL樣品勻液至7.5%氯化鈉肉湯管(如接種量超過1mL,則用雙料7.5%氯化鈉肉湯)。每個稀釋度接種3管,將上述接種物於36℃±1℃培養18~24h。用接種環從培養後的7.5%氯化鈉肉湯管中分別取培養物1環,移種於Baird-Parker平板,36±1℃下培養24~48h。
3.3 平板分離劃線
用接種環從培養後的7.5%氯化鈉肉湯管中分別取培養物1環,移種於Baird-Parker平板,36±1℃下培養24~48h。
3.4 鑒定試驗
MPN法的鑒定試驗過程及注意事項按第一法的“1.4”“1.5”進行。
3.5 查MPN表確認結果
MPN結果按GB 4789.10-2016中附錄C查詢。
4 總結
以上便是金黃色葡萄球菌檢樣3種方法的簡單操作過程。該菌檢測過程的關鍵步驟是劃線分離和可疑菌落的判定,其中不要放過任何一個可疑菌落;檢測人員進行血漿凝固酶試驗時,需要注意對時間和凝固現象的把控,有些細節的處理還需要大量經驗的積累。
熱點推薦
-

全十紅紅稗餅幹|中秋團圓,回家必備
-

和汪氏蜂蜜共同來普及蜂蜜結晶現象
-

拿坡海開啟西餐加盟新潮流, 大眾化家庭小西餐成未來新趨勢
-

摩購空間“霸王餐”來襲 打破傳統營銷套路帶動商家業績翻倍
-

開學季食安隱患猛增 禧雲食安開展公益行動助力意識提升
-

金黃色葡萄球菌檢驗技術介紹及分析
-
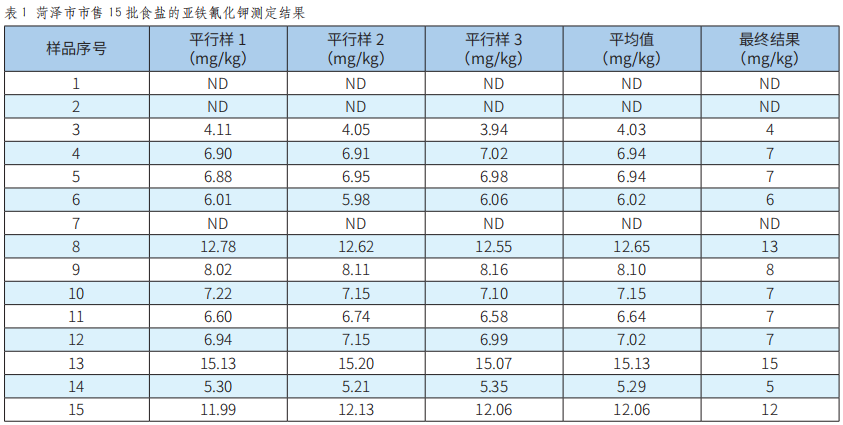
市售食鹽中亞鐵氰化鉀含量的測定
-

包裝飲用水中微生物快速檢測的必要性分析
-

MALDI Biotyper®提高了中國工業微生物菌種保藏中心微生物鑒定
-
基於多反應監測模式下的超高效液相色譜-串聯質譜法檢測動物源性
-

安捷倫攜手華大智造,共同推動實驗室信息化係統與測序平台深度結
-
全自動在線免疫親和固相萃取-液相色譜法快速定量檢測植物油中的
-
基於酵母測試片促生長因子的研究
-
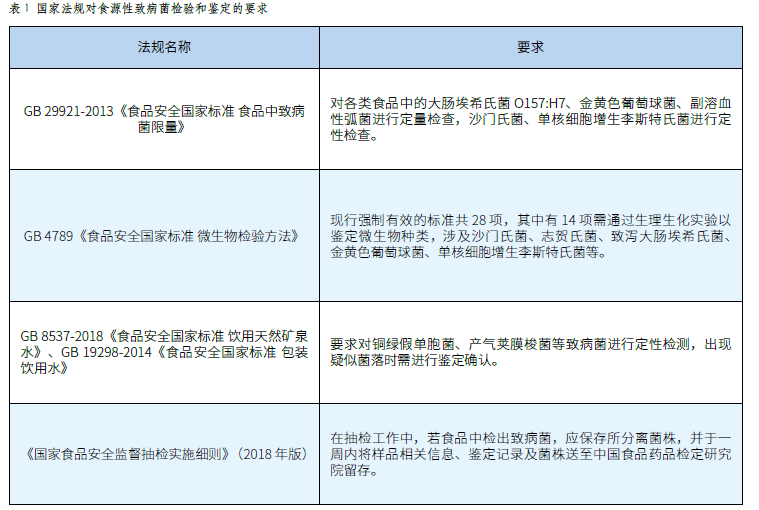
致病菌檢驗和鑒定技術在世界杯賽程預測 保障中的應用
-

多方共建高效檢測體係,讓真菌毒素無處遁形
-

安捷倫在BCEIA2019上展示創新產品和服務
-

非洲豬瘟的快速檢測——速芯科技
-
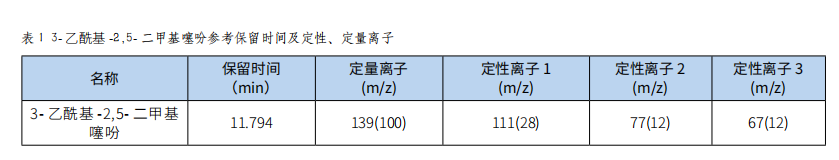
氣相色譜-質譜法測定食品中3-乙酰基-2,5-二甲基噻吩的含量
-

副溶血性弧菌的特征、分布及其致病風險評估研究概述
-
食品中的致病微生物沙門氏菌的商業化檢測技術
-

領創前行、質能譜動,賽默飛於ASMS 2019發布高分辨質譜新品
-

常見真菌毒素的解讀及其檢測方案
-

MALDI-TOF MS在食品微生物中的應用:數分鍾內確認和鑒定微生物
-

液相色譜串聯質譜法檢測雞蛋中磺胺類藥物
-

專業做產品、專注做服務,美正集團為世界杯賽程預測 行業貢獻力量
-
島津LabSolutions:實現網絡時代創新性分析操作環境下的信息安全與
-

同方威視應用拉曼光譜技術,為食品快檢行業賦能
-

聚焦安捷倫高端對話,探索食品檢測創新技術
-

打造受業界尊敬且具有崇高公信力的第三方檢測機構——SAG中檢聯
-

賽默飛SEMICON新品首發,助力我國半導體事業發展





