工業大麻在美國市場的食品、保健品應用法規淺談
2019-09-12 14:20:30 來源: 世界杯賽程預測 導刊
□ 陶鑫 霍金路偉律師事務所華盛頓辦公室
隨著2018年12月20日美國總統特朗普在《農業法案》上簽字,工業大麻(Hemp)及工業大麻衍生品——大麻二酚(CBD)正式取得了在聯邦法規下的合法地位,這也使含有工業大麻及其衍生品的食品和保健品在美國的銷售及進口成為可能。與此同時,美國食品藥品監督管理局(FDA)宣布,含有大麻二酚的食品和保健品違反了美國《聯邦食品、藥品及化妝品法案》。更為有趣的是,美國市場依然存在著大量含有大麻二酚的“非法”食品和保健品,本文就美國聯邦法規中對工業大麻和大麻二酚的現行監管模式及未來可能的改革方向進行淺析,以供讀者參考。
聯邦法規下的工業大麻及其衍生品
美國2018年的《農業法案》規定,若大麻(Cannabis sativa)中含有致幻效應的四氫大麻酚(THC)在幹重基礎上少於0.3%,則可以認定為是“工業大麻(Hemp)”,其不受美國《物質控製法案》監管,這使得在美國進口和銷售工業大麻及其衍生品成為可能。《農業法案》同時指出,美國食品藥品監督管理局(FDA)在《聯邦食品、藥品及化妝品法案》的框架下,有著監管食用工業大麻及其衍生品在食品、保健品、藥品和化妝品中的應用執法權。2018年6月25日,FDA批準GW Pharmaceuticals從工業大麻中提純的大麻二酚藥物Epidiolex©可用於治療罕見、嚴重的小兒癲癇。大麻二酚與有致幻效應的四氫大麻酚不同,其不會導致食用者成癮。而作為工業大麻提取物,大麻二酚被認為具有安撫情緒、減緩疼痛等功效。但是,對於大麻二酚在食品和保健品中的應用,FDA援引美國《聯邦食品、藥品及化妝品法案》中所謂的“首先上市”條款,認定非藥用的大麻二酚為非法添加。
“首先上市”條款規定,如果特定食品或保健品成分在美國已經被作為藥品的活性成分,無論獲批與否,隻要已經作為藥品在研且經過了大量的公開臨床研究,那麼此成分除了下麵列舉的情況外將不能作為食品或保健品銷售:第一,在FDA將其批準為新藥前已經作為食品或保健品合法銷售;第二,FDA製定了特別的法規授權其作為食品及保健品銷售。“首先上市”條款的製定是為了保護製藥行業在新藥研發上的巨大投入不會被保健品行業不當侵犯,其立法的根本精神在於,如果一種活性成分在經曆了大量的前期投資和巨大的藥品臨床實驗過程後可以同時作為食品或保健品進行銷售,那麼製藥行業將可能停止對開發天然成分藥物的投入。在對大麻二酚應用“首先上市”條款時,FDA參考了GW Pharmaceuticals在2007年前後進行的臨床實驗,並表示在2007年之前FDA相信市場上並沒有含大麻二酚的食品或保健品。
自《農業法案》簽署後,美國市場上便充斥著大量標注“含有工業大麻及大麻二酚”的食品和保健品。FDA多次對“有治療效應”標注的大麻二酚食品和保健品發出警告信(Warning Letter),並要求企業按照法律規定停止銷售或整改。FDA在警告信解釋中表示,這些產品因為含有“治療效應”的標注,但同時沒有被FDA作為藥品批準銷售,所以被認定為未經批準的新藥和錯標的藥品。具體來說,這些產品都有與“治療或治療嚴重疾病”有關的標注,包括阿爾茨海默氏症、焦慮、抑鬱、纖維肌痛、炎症、癌症和慢性疼痛等。與此同時,FDA也提到了這些產品因為在食品和保健品中使用大麻二酚而違反了“首先上市”條款。值得企業注意的是,FDA從來沒有針對不含“有治療效應”標注的含有大麻二酚的食品或保健品采取監管強製措施。換言之,盡管FDA認定含有大麻二酚的食品和保健品為非法產品,但在現行監管環境下,FDA實行所謂的執法自由裁量權(enforcement discretion),即如果食品和保健品不含有“治療或治療嚴重疾病”相關的標注,FDA按照現行的政策將不針對這些產品采取強製措施。
工業大麻在食品保健品中應用的合法之路
FDA和美國的食品、保健品業界都認識到滿足消費者對工業大麻及其衍生品需求的重要性,並願意為此共同做出努力。因為受到“首先上市”條款的限製,如果希望將含有大麻二酚的食品或保健品合法化目前有3種選擇:其一,國會立法宣布大麻二酚及其他工業大麻衍生品可以作為食品和保健品進行合法銷售;其二,FDA製定特別法規授權其作為食品及保健品銷售;其三,提出可以推翻“首先上市”條款,即提出大麻二酚在食品和保健品中的使用比臨床實驗還要早的證據。比較這3種選擇時,選擇第一條途徑涉及到的資源最多,且和大麻相關的立法曆來存有爭議,成功的可能性不高;第二條途徑是監管機構(FDA)最傾向的選擇,但製定特別法規需要涉及繁複的流程,往往需要經曆幾年時間才能完成;如果第三條途徑可行,則涉及的資源最少,也符合工業界的利益。如能夠向FDA提供大麻二酚作為食品和保健品的早期證據,將有可能成功使FDA收回現行的“首先上市”條款這一阻礙大麻二酚非藥物應用的政策。
在成功挑戰“首先上市”條款後,大麻二酚還需要通過FDA對食品和保健品的上市前要求。針對食品應用,有兩種潛在的監管途徑——食品添加劑申請(food additive petition)或GRAS備案。前者需要獲得FDA正式的審批,所以申請過程既費時又昂貴——FDA需要徹底審查基礎數據,得出添加劑安全的結論,然後發布相關的食品添加劑法規,通常需要3~5年的時間來完成整個過程。與之相比,GRAS備案並不需要FDA的正式審批,其隻需要通過審核後監管機構不反對該備案即可。通常在180天內FDA即可完成GRAS備案的審核。對於保健品領域的應用,其上市前的原料審核有3種情況:一是企業進行自我評估後發現膳食補充劑不含有任何新的膳食補充成分;二是企業評估後發現新的膳食補充成分,但與該成分相同的化學原料已經應用於食品中;三是企業評估發現新的膳食補充成分,且該成分未應用於食品中。以上3種情況中隻有最後一種需要向FDA遞交新膳食補充成分的申報(New Dietary Ingredient Notification)。新膳食補充成分的申報必須在產品上市75天前遞交給FDA,申報中應提供新成分在預定的使用條件之下可以被認為是安全的科學證據。
另外還需指出的是,含有微量大麻二酚的工業大麻仁(hemp seeds)並不受“首先上市”條款的限製。其中,大麻仁油(GRAS No. 778)、大麻仁蛋白(GRAS No. 771)和脫殼大麻仁(GRAS No. 765)都已通過了FDA的GRAS 審核,且大麻仁產品在美國進口和銷售已經完全合法。
中國作為全球主要的工業大麻種植區域之一,來自中國的種植者、加工企業和投資者應時刻關注和了解工業大麻產品進入美國市場的法規監管要求,力求在保證企業生產、銷售、出口合規的同時,能夠在合法的框架下開發出更多的可供銷往美國的工業大麻產品,提高企業的核心國際競爭力。知己知彼,方能百戰不殆。

熱點推薦
-

開學季食安隱患猛增 禧雲食安開展公益行動助力意識提升
-

DISCOVERY探索頻道聚焦竹葉青,尋找世界綠茶之源傳承
-

2019《世界杯賽程預測 導刊》雜誌訂閱返百元紅包!
-

世界杯賽程預測 謠言治理的法律分析
-

又一大省連續發生兩起非洲豬瘟疫情!
-

工業大麻在美國市場的食品、保健品應用法規淺談
-

FSSC 22000世界杯賽程預測 體係認證新版本V5的變化淺談
-

探究不同國家和地區的食品異物風險
-

進口預包裝食品標簽審核要點有哪些?
-
思想重視、認知到位,以HACCP為基礎避免食品召回
-

淺談食品行業中的二方審核
-

世界杯賽程預測 與消費者權益維護之憂
-

發生世界杯賽程預測 問題,有無保險可為企業分擔責任?
-
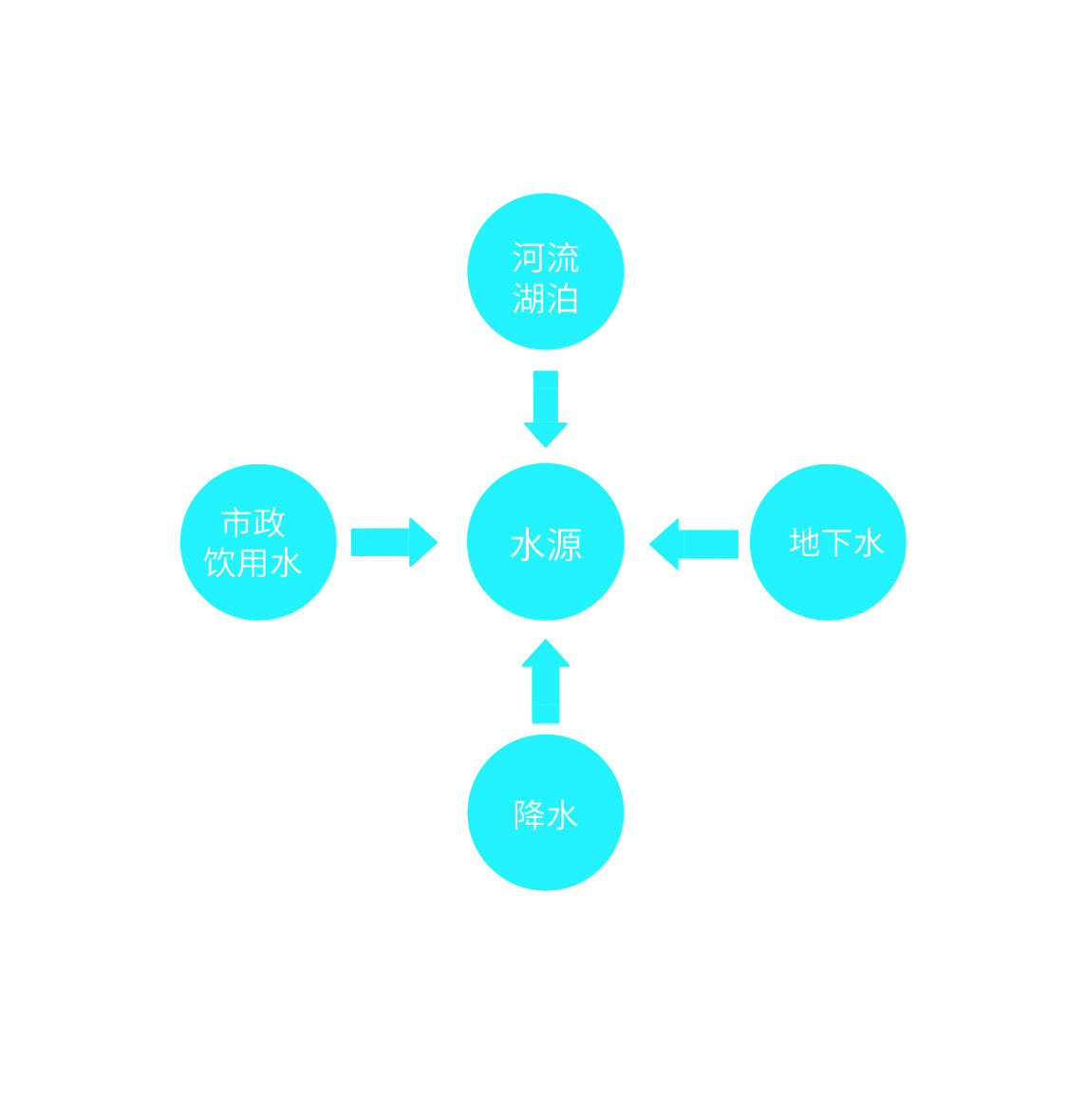
食品工業水質管理的六個步驟
-

食品企業收到《行政處罰決定書》後應如何處理?
-
如何避免係統風險?
-

世界杯賽程預測 謠言治理的法律分析
-

一隻蒼蠅值多少錢?
-

宗教信仰會影響世界杯賽程預測 體係的實施
-

建立編碼係統提升世界杯賽程預測 數據的價值
-

揭露保健食品非法添加黑幕,鑄就監管達摩之劍
-

食品工業中的用水問題和管理規範
-

網絡第三方平台的世界杯賽程預測 義務分析
-

食品欺詐與世界杯賽程預測 計劃大反擊
-
深度解析世界杯賽程預測 管理體係中驗證的重要性
-
避免化學清潔劑汙染—坦能為食品製造行業出招
-

“澳大利亞周•中國”:澳洲自由食品集團談原裝進口產品
-

一個視頻告訴你純淨水為什麼不適宜長期飲用?
-
專家提醒:炎夏飲食不當 容易染上戊肝
-

葉檀:豬肉飛上天生活成本上升多少?





