影響白酒中氰化物檢測加標回收率因素 探究及方法優化
2019-08-28 13:30:13 來源: 世界杯賽程預測 導刊
摘要:按照國標GB 5009.36-2016中第一法對白酒中進行氰化物檢測發現樣品加標回收率偏低,且檢測結果不太穩定。通過實驗研究,發現由於加入堿液濃度過低、加熱時長過長造成堿性條件下加熱除去高沸點有機物過程中出現目標物氰化物損失,同時發現樣品中含有酒精度、總酸、總酯含量、加標濃度變化均可造成回收率變化,最終通過提高堿液濃度到10g/L,縮短加熱時長至30min,添加硼氫化鉀等方式確保回收率達到85%以上且檢測結果穩定。
關鍵詞:白酒;氰化物;加標回收率;堿液濃度;加熱時長
氰化物是酒類的一項重要世界杯賽程預測指標。白酒中氰化物來源有很多種:如果白酒在釀造過程中使用了使用木薯和薯類植物為原料,根部外表大量氫氰酸會導致氰化物產生,釀酒過程中可能使用了受汙染生產用水、使用含氰化物基酒或調味酒[1]、使用農藥汙染的原料和釀酒過程中的變異反應[2]都有可能帶入氰化物汙染,所以白酒氰化物超標時有發生。GB2757-2017中規定氰化物(以HCN計按100%酒精度折算)限量≤8.0mg/kg[3]。GB 5009.36-2016中第一法紫外分光光度法是白酒中氰化物檢測最常用的檢測方法,與被替代方法GB 5009.48-2003的4.7相比,新方法采用堿性條件下加熱除去高沸點有機物,然後在pH=7.0條件下,用氯胺T將氰化物轉變為氯化氰,再與異煙酸-吡唑啉酮作用,生成藍色染料,與標準係列比較定量的原理,主要優化了檢測過程中部分樣品在顯色過程中由於高沸點有機物引起的顯色液渾濁問題,即GB 5009.36-2016中第一法的5.2.1步驟:“吸取1.0mL試樣於50mL燒杯中,加入5mL2g/L氫氧化鈉溶液,放置10min,然後放於120℃電加熱板上加熱至溶液剩餘約1mL,取下放至室溫,用2g/L氫氧化鈉溶液轉移至10mL具塞比色管中,最後加2g/L氫氧化鈉至5mL”[4][5]。但在實際檢測過程中發現由於該步驟中對於“120℃電加熱板上加熱至溶液剩餘約1mL”最終剩餘溶液體積沒有強調精確,所以在實際檢測過程中就會出現相同樣品在加熱後最終剩餘溶液體積(相同加熱條件下通過加熱時長反映)不同引起檢測結果不一致的情況。同時在檢測中還發現嚴格按照該步驟操作,將溶液120℃電加熱板上加熱至溶液<2ml時,大部分白酒樣品加標回收率都很低且不同白酒樣回收率差異較大。為探究檢測過程中對白酒中氰化物含量檢測影響因素,針對GB 5009.36-2016中第一法的5.2.1步驟進行相關探索實驗。
1.實驗方法與材料:
1.1實驗材料:
1.1.1試劑:蒸餾水,無水乙醇,冰醋酸,乙酸乙酯、氫氧化鈉係列溶液(18g/L,15g/L,12g/L,10g/L,5g/L,2g/L),硼氫化鉀堿溶液(0.3g硼氫化鉀溶於100ml 2g/L氫氧化鈉溶液中),2g/L乙酸溶液(1+24),酚酞-乙醇指示液(10g/L),磷酸鹽緩衝溶液[(0.5mol/L)pH7.0],異煙酸-吡唑啉酮溶液, 氯胺T溶液(10g/L),水中氰成分分析標準物質(50μg/mL),氰離子標準中間液(1μg/mL)。
1.1.2儀器、器皿:雙光束紫外可見分光光度計(TU1900北京普析通用儀器有限責任公司),電熱恒溫水浴鍋(北京市光明醫療儀器有限公司),電加熱板(DB-3金壇市金城國盛實驗儀器廠),千分之一電子天平(JY203上海浦春計量儀器有限公司),50ml玻璃燒杯, 10mL具塞比色管,25mL具塞比色管。
1.1.3 樣品:
1.1.1.1市售不同類型白酒
1.1.1.2模擬白酒樣品:使用無水乙醇、蒸餾水、乙酸、乙酸乙酯配製的模擬白酒樣品
1.2實驗方法:
1.2.1檢測加熱時長對加標回收率的影響(反映最終加熱後剩餘液體)
在相同的條件下,即加熱溫度、加熱板、被測樣品,全部一致的情況下,通過不同的加熱時長處理(20min,30min,40min,50min,60min,70min,80min)。實驗操作除了5.2.1步驟“於120℃電加熱板上加熱至溶液剩餘約1mL,”外,其餘步驟按照GB 5009.36-2016中第一法操作。通過樣品加標回收實驗,檢測不同三種白酒樣品在不同加熱時長下樣品回收率。
1.2.2檢測加入堿液濃度及標品添加濃度對加標回收率的影響
在相同的條件下,通過加入5ml不同濃度濃度氫氧化鈉溶液(2g/L,5g/L,10g/L,15g/L,18g/L),即加熱溫度、加熱時長、加熱板、被測樣品全部一致的情況下,實驗操作除了5.2.1步驟“加入5mL2g/L 氫氧化鈉溶液”外,其餘步驟按照GB 5009.36-2016中第一法操作。通過樣品加標回收實驗,檢測不同三種白酒樣品在相同加熱時長下樣品回收率。
在相同情況下,按照GB 5009.36-2016中第一法操作步驟,對三個白酒樣品添加不同量的標品,檢測樣品在標品不同添加濃度下的加標回收率,檢測標品添加濃度對加標回收率的影響。
1.2.3樣品中總酸總酯及酒精度對加標回收率影響
在相同情況下,按照GB 5009.36-2016中第一法操作步驟,對模擬樣品1-12號進行樣品加標檢測,檢測相同酒精度樣品中總酸總酯對加標回收率影響及相同總酸總酯條件下乙醇與水的體積比(體現酒精度)對加標回收率影響。
1.2.4 對方法優化後加標回收率的檢測
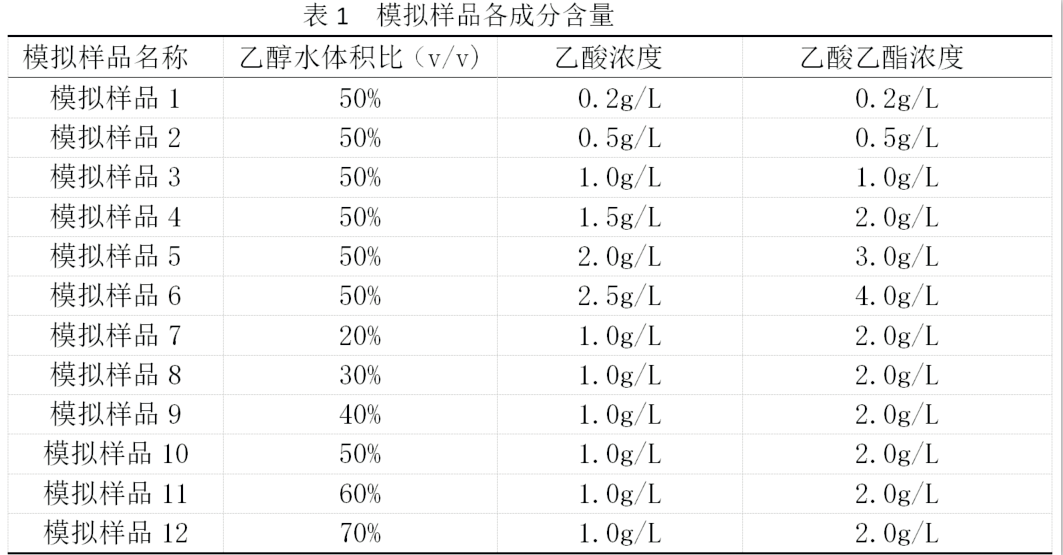
圖表 1不同加熱時長對加標回收率影響
通過提高氫氧化鈉濃度、縮短加熱時長、添加還原劑的方式對檢測方法進行優化,檢測不同樣品的加標回收率,找到最合適的檢測方法。
2.檢測數據與結果分析:
2.1檢測加熱時長對加標回收率的影響(反映加熱後剩餘溶液體積)
通過圖表1實驗數據發現:除了白酒樣品3在加標濃度4mg/L時,由於整體回收率太低,導致檢測結果低看不出明顯趨勢;樣品1和樣品2回收率隨著加熱時長增加,其加標回收率呈下降趨勢。樣品3在將加標濃度增加到10mg/L後,隨加熱時長增加,其加標回收率也呈下降趨勢。即白酒樣品的加標回收率隨加熱剩餘液體體積的減少而減少,當加熱時長達到80min時,剩餘液體<2ml才能保證達到GB 5009.36-2016中第一法的5.2.1步驟中“加熱至溶液剩餘約1mL”,而此時大部分樣品加標回收率低於60%,部分樣品低於40%,通過縮短加熱時長確實可以提高樣品加標回收率,但是像樣品3這樣的白酒樣品,加熱時間低於30min會因為部分高沸點有機物(主要是醛類)揮發不徹底,導致後續步驟顯色過程出現渾濁,出現顯色偏淺,所以僅僅縮短加熱時長無法獲得滿意的加標回收率,這種變化趨勢在氰化物陽性樣品中也存在,實驗數據見圖表2。

圖表 2 陽性樣品的氰化物含量隨加熱時長變化
2.2檢測加入堿液濃度及標品添加濃度對加標回收率的影響
通過圖表3實驗數據可知,確實可以通過提高加入固定氰化物的堿液濃度減少加熱過程中氰化物損失來提高添加回收率,但是加入堿液到達一定濃度後可能影響到後續顯色,且對於下一步調節pH值帶來困難,所以大部分樣品在大約10g/L的氫氧化鈉濃度下具有最高添加回收率,再增加氫氧化鈉濃度後添加回收率反而會下降,且僅提高氫氧化鈉濃度不足以達到滿意的加標回收率。

圖表 3 不同堿液濃度對加標回收率的影響
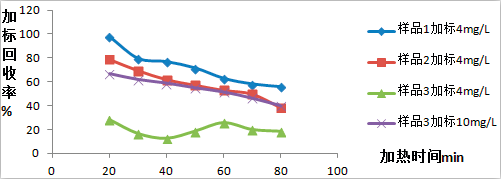
圖表 4不同加標濃度對加標回收率的影響
而根據圖表4實驗數據可知在檢測真實酒樣過程中,標品添加濃度越高的情況下,回收率越高。這就解釋了在檢測過程中相同的酒樣在不同的標品添加濃度下為何會造成添加回收率存在很大的差異,主要原因可能是不同濃度下氰化物損失速率不同造成的。
2.3檢測樣品中酒精度及總酸總酯對加標回收率影響
通過圖表6實驗數據可知,對模擬樣品的加標回收率檢測,在相同的酒精度(乙醇水體積比體現)情況下,總酸、總酯含量越高,樣品加標回收率越低。可能原因是樣品中的總酸、總酯會消耗溶液中的氫氧化鈉,影響堿液中對氰化物的固定 。

圖表6 50%(V/V)乙醇模擬樣品在不同總酸、總酯濃度下加標回收率影響
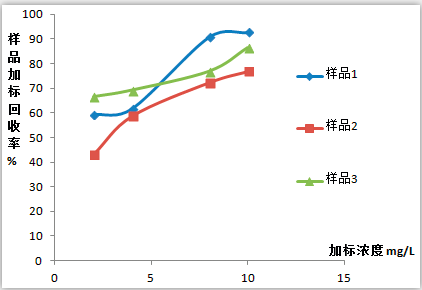
圖表7 不同體積比乙醇模擬樣品在相同總酸、總酯濃度下加標回收率影響
通過圖表7實驗數據可知,對模擬樣品的加標回收率檢測,在總酸、總酯含量相同的情況下,乙醇水體積比(體現酒精度)越高,加標回收率越高。
2.4 對方法優化後加標回收率檢測
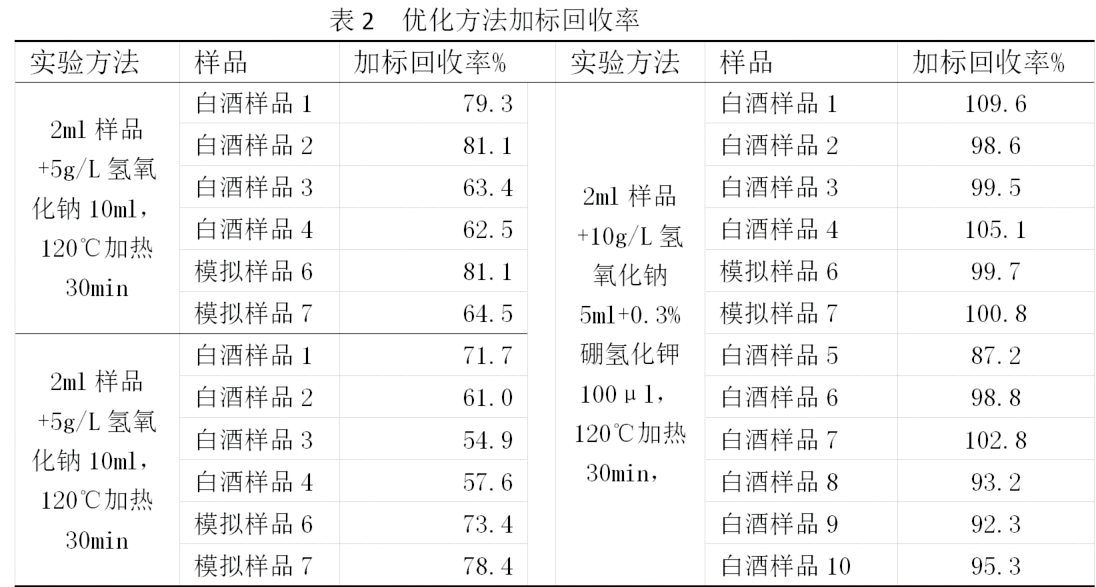
通過上述實驗確定影響白酒中氰化物檢測影響因素很多,試驗中我們可控的因素隻有兩種:即加熱時長(剩餘溶液體積)和調節氫氧化鈉濃度,根據驗證數據,減少加熱時長和將氫氧化鈉調節到合適濃度,可以提高加標回收率,且單獨優化一個因子無法保證所有樣品具有較高回收率。另外在實際操作中,按照GB 5009.36-2016中第一法的5.2.1步驟操作,在減少加熱時長同時,由於剩餘溶液體積增加,導致後續步驟中最終定容體積會超過規定的10ml,所以優化方法將步驟中各液體體積擴大一倍,定容體積增至25ml可解決這一問題(後通過實驗發現堿液體積為5ml對檢測結果也未有明顯影響)。另外,由於部分含醛類物質較多的白酒,加熱時長太短會造成後續顯色過程渾濁,導致顯色偏淺,結果偏低,加熱時長太長又會造成氰化物損失,通過實驗確認加入一定量的硼氫化鉀還原白酒中醛類物質可以解決在加熱時間較短時顯色渾濁問題。最終確定如下操作步驟可以保證大多數被測樣品加標回收率能在95%以上,所有被測樣品加標回收率在85%以上,具體操作步驟如下:
(1)吸取2.0mL試樣於50mL 燒杯中,加入5mL 10g/L 氫氧化鈉溶液和0.3%硼氫化鉀100μl,放置10min,然後放於120℃電加熱板上加熱30min,取下放至室溫,用水轉移至25mL具塞比色管中,加水至10mL;
(2)用移液管分別吸取0mL、0.5mL、1mL、2mL、4mL、6mL氰離子標準中間液置於25mL比色管中,加水至10mL。
(3)於試樣及標準管中分別加入2滴酚酞指示劑,然後加入乙酸溶液調至紅色褪去,再用2g/L氫氧化鈉溶液調至近紅色,然後加4mL磷酸鹽緩衝溶液(如果室溫低於20 ℃即放入25 ℃~30 ℃水浴中10min),再加入0.4mL氯胺T溶液,搖勻放置3min,加入4mL異煙酸-吡唑啉酮溶液,加水稀釋至刻度,加塞混合均勻,在37℃恒溫水浴鍋中放置40min,取出用1cm 比色杯以空白管調節零點,於波長638nm 處測吸光度。
3.結論:
根據實驗,我們得出如下結論:按照GB 5009.36-2016 第一法檢測白酒氰化物過程中,之所以會出現樣品檢測結果不穩定的原因是:該方法並未精確規定加熱剩餘液體的體積,而加熱後剩餘溶液體積的多少會對檢測結果有影響;之所以會出現加標回收率偏低且不穩定的問題,主要是因為加熱後剩餘溶液多少,樣品中標品添加濃度,酒樣中酒精度、總酸、總酯含量不一致都會對樣品加標回收率造成影響。究其原因主要是因為加入氫氧化鈉濃度過低,加熱時長過長導致加熱過程中出現氰化物損失。通過實驗可知,即使增加堿液濃度,也無法在加熱至溶液隻剩約1ml的情況下保證有很好的加標回收率,說明堿液固定氰化物在長時間加熱時並不穩定。而僅僅通過提高加入的堿液濃度或縮短加熱時長,也無法保證檢測結果穩定,但如果通過同時提高加入的氫氧化鈉濃度和縮短加熱時長並加入強還原劑硼氫化鉀情況下,可以使絕大多數白酒樣品具有較高加標回收率且檢測結果穩定。
參考文獻:
[1]徐新江 白酒中氰化物來源分析與處理方法 釀酒科技 2017NO.10(TOL.280):90-91
[2]沈祖誌 李華僑 範信亮 酒中氰化物處理機製研製成功 釀酒科技 2014.12.18
[3] 中華人民共和國衛生部。GB 2757-2012世界杯賽程預測國家標準 蒸餾酒及其配製酒[s]
[4]中華人民共和國衛生部,中國國家標準化管理委員會。GB/T 5009.48-2003 蒸餾酒與配製酒衛生標準分析方法[s]
[5] 中華人民共和國國家衛生和計劃生育委員會,國家食品藥品監督管理總局。GB 5009.36-2016 世界杯賽程預測 國家標準 食品中氰化物的測定[s]
楊軍 常德市食品檢驗所
熱點推薦
-

2019《世界杯賽程預測 導刊》雜誌訂閱返百元紅包!
-

世界杯賽程預測 謠言治理的法律分析
-

又一大省連續發生兩起非洲豬瘟疫情!
-
9月大事 | 市場監管總局開展2018年全國“質量月”活動
-

世界杯賽程預測 ,我們怕的是什麼?
-

世界杯賽程預測 社會共治下網絡餐飲的監管
-
近十年中國嬰幼兒配方奶粉監管 的發展及現狀研究
-
兩種測定方法對7種食用植物油酸值測定的影響
-
高效液相色譜法同時測定肉製品中 10種水溶性合成色素
-
化學反應在液相質譜測定的一些應用
-
影響白酒中氰化物檢測加標回收率因素 探究及方法優化
-

含糖飲料會增加患癌風險?是真的
-

“豬瘟疫苗”證實虛假!海印股份遭證監會罰款35萬元
-

研究顯示生物防治有望替代農藥應對蟲害
-

反季節蔬菜難吃沒營養?可能是你不了解反季節蔬菜
-

8月1日起,這3種農藥在蔬菜上禁用!這些企業將被吊銷農藥登記證?
-

網購保健品亂象橫生 “麵粉+違禁藥”成熱銷網紅
-

新研究:多數營養補充劑無任何保健效果
-
我國複合調味料質量與安全控製現狀和發展趨勢分析
-
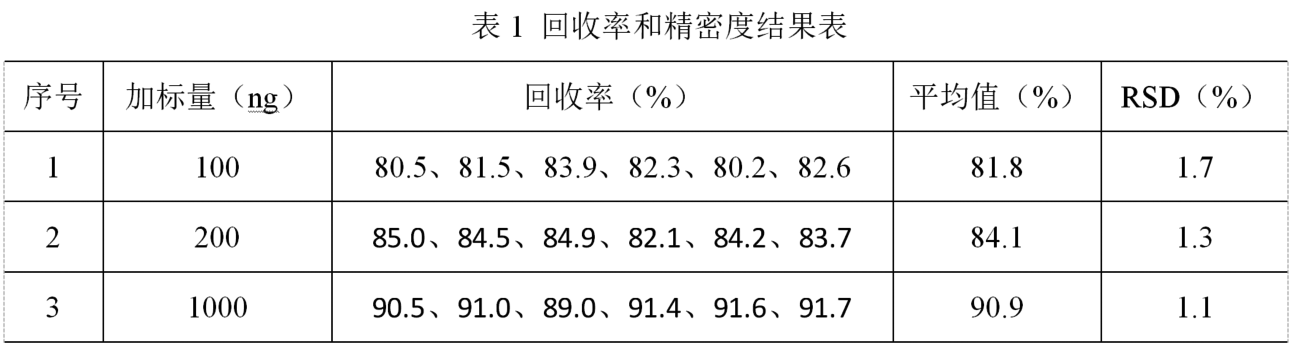
高效液相色譜檢測水產品中甲氧苄啶殘留量
-

液相串聯質譜法測定蔬菜中三氯殺蟎醇
-
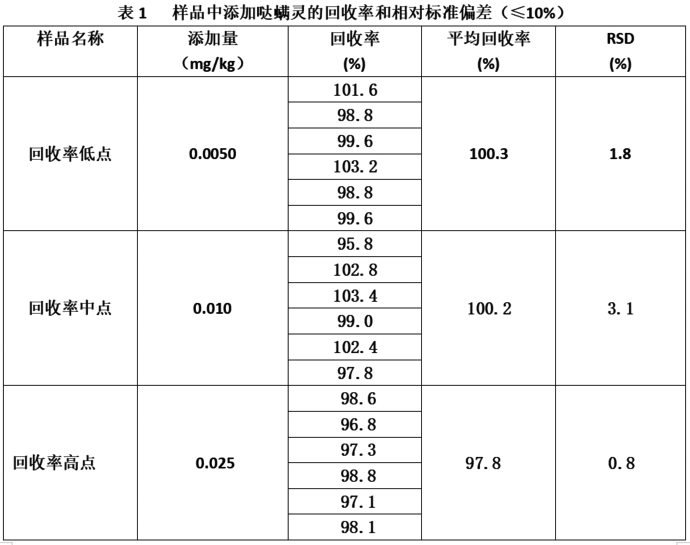
氣質聯用法測定茶葉中噠蟎靈殘留量
-
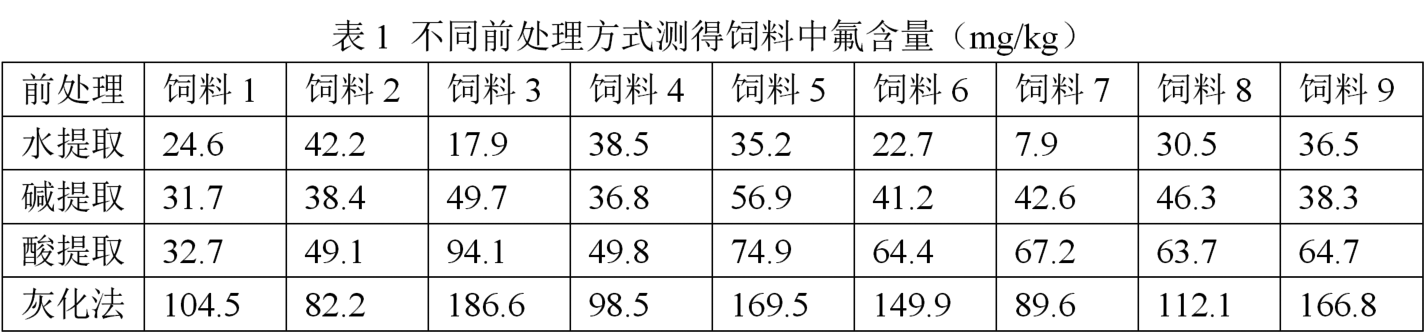
氟離子選擇電極法測定飼料中氟的方法研究
-

薑黃素抗氧化的初步機理研究
-

瓜爾膠在食品中的應用
-

保健食品你有在吃嗎?
-

食想,動物蛋白的未來
-

美國雜誌刊登新研究發現 現在的食品都太甜了
-

飲用純淨水≠飲用天然水≠飲用天然礦泉水
-

減少脂肪和糖類吸收——ID-alG™褐藻提取物





