薑黃素抗氧化的初步機理研究
2019-07-26 13:29:30 來源: 世界杯賽程預測 導刊
摘要:
薑黃素(curcumin, Cur)是一種多酚類食品添加劑,具有抗炎等生理功能。這可能與其抗氧化能力密切相關,但作用機製尚不明確。本研究通過對薑黃素作用細胞的檢測,發現薑黃素提高細胞的總抗氧化能力,降低活性氧(reactive oxygen species,ROS)水平;同時抗氧化酶超氧化物歧化酶(SOD)、穀胱甘肽過氧化物酶(GPx)的表達和活性均有上調。這些結果提示薑黃素可能通過對SOD和GPx的調節提高細胞的抗氧化能力,進而減少ROS造成的損傷。
關鍵詞:活性氧(ROS);線粒體;抗氧化酶
薑黃起源於印度,是常用的香料及色素,是製作咖喱不可或缺的主要材料,有高達六千年的食用曆史,且具有較強的保健功效[1]。薑黃素(curcumin, Cur)是薑黃的主要成分之一。它是一種多酚類化合物,也是植物界中很稀少的二酮類色素,為橙黃色結晶粉末,味稍苦,不溶於水[2],與脂類食物一同食用更易吸收利用。作為薑黃的主要功效成分,薑黃素已通過國家食品藥品監督管理局、糧農組織以及世界衛生組織食品添加劑聯合專家委員會的安全性及毒性檢測[3]。薑黃素因其分子中含有多個雙鍵,以及酚羥基和羰基等活性基團,在護胃、保肝、抗氧化、增強免疫力、減肥等多個保健功效方麵都具有很好的作用[1]。在亞洲一些國家,傳統的飲食習慣使人們攝入較少的飽和脂肪酸和含糖食物,而攝入含有豐富的化學防護物質的植物,如薑黃素的攝入量(約 100 mg /d)明顯高於西方國家[4]。在印度等經常攝入薑黃素的國家,肝癌等高發癌症的發病率遠低於美國[5]。但是,薑黃素的作用機理尚未十分明確,進一步的探究可以幫助指導薑黃素的膳食攝入。
現代醫學研究發現人體眾多病變的引發與活性氧(reactive oxygen species,ROS)的形成有關,ROS氧中的自由基可通過致癌基因的激活、抑癌基因的失活、活化致癌物等途徑引發癌症[6]。因此,增強自由基捕獲能力, 消除或減輕自由基所造成的氧化損傷, 是預防和阻斷癌症發展的有效方法[7]。薑黃素的多種活性與其抗氧化作用相關[8]。本文通過檢測薑黃素對HepG2細胞抗氧化能力的影響,探究其可能的調節機理,可能為薑黃素對ROS相關疾病的預防保健提供理論依據。
方法
細胞培養及薑黃素處理
HepG2細胞購自上海中國科學院細胞庫,培養基為含10%胎牛血清及1%青黴素-鏈黴素溶液的DMEM高糖培養基(SH30022.01,Hyclone),培養在37℃,含 5%CO2的細胞培養箱中。薑黃素處理方法:薑黃素(C1386,Sigma)以二甲基亞碸(DMSO,Amresco)為溶劑,配製成27 mM的母液。將細胞以4×105/ mL的密度接種於六孔板中,過夜培養後加入薑黃素至終濃度5、10、15 μM,繼續培養24小時。
細胞增殖率檢測
將HepG2細胞以1×105/ mL的密度接種於96孔培養板,每孔100 μL。細胞貼壁後,加入薑黃素繼續培養24小時,每孔加入20 μL濃度為 5mg/mL的四甲基噻唑藍(MTT,奧多福尼),37℃孵育4 h後吸棄上清,加入150 μL DMSO以溶解生成的甲臢,繼續震蕩10分鍾,用多功能酶標儀(SYNERGY/H1,Biotek)測定A490,以溶劑為對照計算細胞相對增殖率。
細胞相對增殖率=(OD實驗組-OD本底)/(OD對照-OD本底)×100%
ROS水平檢測
采用活性氧檢測試劑盒(S0033,碧雲天),按產品說明書進行操作。即細胞用薑黃素處理24 h後吸棄培養基,加入含10 μM DCFH-DA探針的工作液於37℃孵育30分鍾,然後用Opti-MEM無血清培養基(31985-070,Gibco)清洗殘餘染料,最後將細胞收集重懸於無血清培養基中,用酶標儀檢測熒光強度(EX488 nm,EM525 nm),並以樣品的蛋白量進行標準化計算單位蛋白量下的ROS水平。
總抗氧化能力檢測
分別選用碧雲天的總抗氧化能力檢測試劑盒S0119和S0116進行檢測。即細胞用薑黃素處理後吸棄培養基,用預冷的磷酸鹽緩衝液(PBS,Hyclone)清洗三遍,細胞收集後重懸於PBS並超聲波破碎,4℃ 12000g離心5分鍾後,收集上清夜用於檢測。按照試劑盒說明書設置檢測體係,用酶標儀檢測吸光值,計算單位蛋白量下的總抗氧化能力。最後將對照設為1,計算相對總抗氧化能力。
抗氧化酶活性檢測
分別采用南京建成生物工程研究所總超氧化物歧化酶(SOD)測定試劑盒(A001-3-2)和 穀胱甘肽過氧化物酶(GSH-PX)測定試劑盒(A005-1-2)、碧雲天的過氧化氫酶(CAT)檢測試劑盒(S0051)進行檢測。SOD和GPx檢測的細胞處理及蛋白樣品提取同總抗氧化能力檢測,CAT檢測采用細胞裂解液(P0013,碧雲天)裂解獲得蛋白樣品。按照試劑盒說明書設置檢測體係,酶標儀檢測吸光值,計算單位蛋白量下的抗氧化酶活性。最後將對照設為1,計算相對抗氧化酶活性。
基因表達水平檢測
采用實時熒光定量PCR(qRT-PCR)法檢測。按Trizol Reagent試劑盒(15596-018,Ambion)的說明提取細胞總RNA,並用M-MLV Reverse transcriptase試劑盒(M1705,Promega)將其反轉錄為cDNA,用TAKARA的SYBR Premix Ex Taq II試劑盒(RR820A)在Applied Biosystems的ABI7300實時熒光定量PCR儀中反應並測定,以GAPDH為內參。本文所用qRT-PCR引物序列如下:SOD2(GCTGCACCACAGCAAGCACC和CCAGCAACTCCCCTTTGGGT)、GPx-1(GTGCTCGGCTTCCCGTGCAAC和CTCGAAGAGCATGAAGTTGGGC)、CAT(GTGCGGAGATTCAACACTGCCA和CGGCAATGTTCTCACACAGACG)和GAPDH(ATGACATCAAGAAGGTGGTG和CATACCAGGAAATGAGCTTG)。目的基因的mRNA相對表達水平以2-∆∆ct公式進行計算。
統計學分析
數據表示為平均值±平均值的標準誤差(SEM),用SPSS 19分析軟件運用單因素方差分析(ANOVA)進行比較,測定數據均獨立重複三次以上進行統計學分析,﹡P<0.05認為數據差異具有統計學意義。
結果
薑黃素對細胞增殖的影響
薑黃素對HepG2細胞增殖的影響如圖1所示。作用24小時後,細胞增殖率隨薑黃素濃度提高略有下降。此時細胞尚能有效調節代謝,因此選擇5~15 μM為薑黃素作用濃度進行後續檢測。

圖1 薑黃素對HepG2細胞增殖率的影響
注:5、10、15 μM薑黃素處理HepG2細胞24小時後進行MTT檢測,將對照(溶劑DMSO處理,即薑黃素濃度為0)的增殖率設為100%。計算細胞相對增殖率。統計分析:單因素方差分析(n≥3)。
薑黃素降低ROS水平
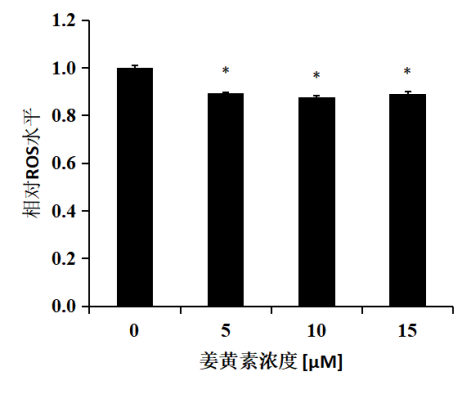
圖2 薑黃素對HepG2細胞ROS水平的影響
確定薑黃素作用濃度後,檢測薑黃素對細胞ROS的影響。結果如圖2所示,與對照相比,薑黃素處理24小時後,細胞ROS含量顯著下降(P<0.05),提示薑黃素能夠顯著抑製HepG2細胞中ROS的積累。
注:5、10、15 μM薑黃素處理HepG2細胞24小時後,薑黃素顯著降低細胞ROS水平。結果表示為與對照(DMSO處理即薑黃素濃度為0)相比的DCFH-DA熒光強度,將對照的ROS水平設為1.0。統計分析:單因素方差分析(n≥3),﹡P<0.05。
薑黃素提高總抗氧化能力
進一步檢測薑黃素對細胞總抗氧化的影響。采用ABTS、FRAP法用碧雲天的檢測試劑盒進行操作。結果顯示,與對照相比,薑黃素處理後,細胞內總抗氧化能力顯著提高(P<0.05)(圖3),提示薑黃素能夠顯著提高細胞抗氧化能力。
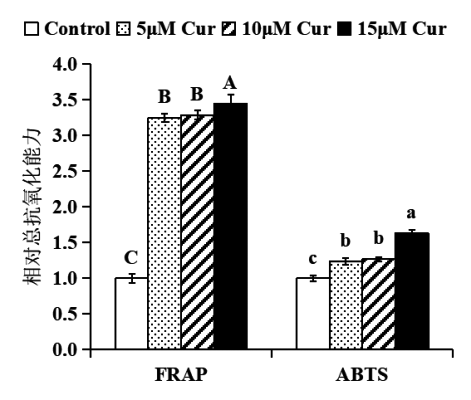
圖3 薑黃素對HepG2細胞總抗氧化能力的影響
注:5、10、15 μM薑黃素處理HepG2細胞24小時後,薑黃素顯著提高細胞總抗氧化能力。結果表示為薑黃素處理樣品與對照(DMSO處理)相比的總抗氧化能力(FRAP法和ABTS法檢測),將對照的總抗氧化能力設為1.0。統計分析:單因素方差分析(n≥3),不同字母的數值間有顯著性差異P<0.05。
薑黃素對抗氧化酶活性及基因表達水平的影響
確定薑黃素提高HepG2細胞的抗氧化能力後,進一步探究其可能的機理。首先檢測薑黃素對細胞抗氧化酶活性的影響,結果如圖4所示。與對照相比,薑黃素處理樣品的SOD及GPx酶活性顯著提高(P<0.05),CAT酶活性變化不大,隻在大濃度薑黃素處理時略有下降。這提示薑黃素能夠提高抗氧化酶SOD和GPx的活性,而對CAT酶活性影響不大。
最後檢測這三種抗氧化酶基因的表達水平。由於金屬輔機不同,SOD分為Fe-SOD、Mn-SOD、Cu/ZnSOD等,其中定位於線粒體的Mn-SOD是清除ROS的主要類型。通過對Mn-SOD(SOD-2)、細胞中的GPx(GPx-1)和CAT的mRNA表達水平檢測發現,與對照相比,薑黃素處理細胞中的SOD-2和GPx-1基因表達水平顯著上調(P<0.05),而CAT基因表達水平無顯著變化。
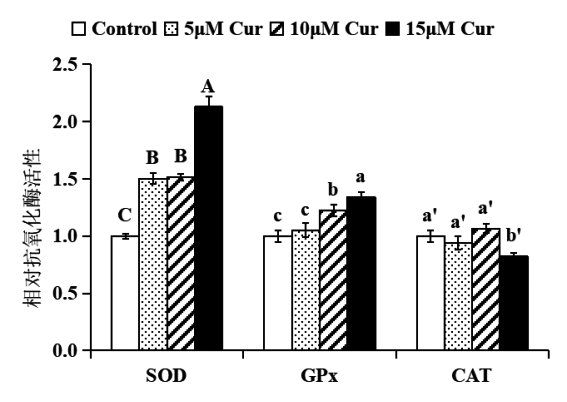
圖4 薑黃素對HepG2細胞抗氧化酶活性的影響
注:5、10、15 μM薑黃素處理HepG2細胞24小時後,薑黃素顯著提高SOD、GPx酶活性,而CAT酶活性變化不

圖5 薑黃素對HepG2細胞抗氧化酶基因表達的影響
大,僅在大濃度薑黃素作用時略有下降。結果表示為薑黃素處理樣品與對照(DMSO處理)相比的酶活性,將對照的酶活性設為1.0。統計分析:單因素方差分析(n≥3),不同字母的數值間有顯著性差異P<0.05。
注:5、10、15 μM薑黃素處理HepG2細胞24小時後,SOD-2、GPx-1基因的mRNA水平顯著上升,CAT基因表達無顯著變化。結果表示為與對照(DMSO處理)相比的目的基因表達水平,以GAPDH為內參,將對照的基因表達水平設為1.0。統計分析:單因素方差分析(n≥3),不同字母的數值間有顯著性差異P<0.05。
討論
薑黃素是世界衛生組織準許使用的食品添加劑,其兩側苯環上的甲氧基能夠增強其抗氧化活性[4]。薑黃素的自由基清除效果強於維生素E多倍,對類自由基的清除作用更強[9],因此它也被應用於膳食保健。但在薑黃素的體內抗氧化活性研究中,它對不同細胞和動物模型的作用效果和機理不盡相同,且可能通過多途徑產生影響[11],因此相關機製還在不斷探究中。
ROS中包含的自由基等強氧化物質會造成細胞氧化損傷(oxidative damage),而氧化損傷與多種慢性病如心血管病、癌症等密切相關[12]。在正常生理狀態下, ROS維持在較低水平,微量的ROS參與細胞內多種生化反應[13, 14],而在癌細胞中ROS過量產生,通過誘導基因組不穩定性,修飾基因表達和參與信號傳導等途徑促進癌變發展[15]。近年來的研究發現,降低ROS產生量能夠降低癌症發病率和病死率[16],抑製腫瘤細胞增殖和血管生成[17, 18]。因此,控製細胞中ROS的產生對預防癌症等機體損傷具有積極作用。本研究顯示薑黃素作用24h顯著降低HepG2細胞的ROS水平。這可能是薑黃素激活了細胞內源性的抗氧化防禦機製,提高了抗氧化能力引起的。抗氧化酶和非酶抗氧化物質是細胞抗氧化活性的重要組成部分,抗氧化酶中SOD是首當其衝的的第一道抗氧化防線,能催化強自由基超氧陰離子O2•—歧化轉化為過氧化氫,過氧化氫由GPx、CAT等抗氧化酶迅速分解生成水和氧氣。本研究結果顯示,薑黃素能夠顯著提高細胞的總抗氧化能力、SOD和GPx酶的活性,提示薑黃素降低ROS累積可能是由提高抗氧化酶活性、增強抗氧化功能引起的。這與曾瑜等的報道[19]類似, 他們發現急性酒精肝損傷小鼠的血清與肝組織SOD、GSH-Px活力會隨薑黃素濃度增加而升高。
Mn-SOD特異性定位於線粒體,其作用在於維持氧自由基的平衡、清除轉移超氧陰離子自由基、防禦氧化損傷。本研究結果顯示,薑黃素能夠顯著提高Mn-SOD、GPx-1的mRNA表達水平,與細胞中SOD和GPx等抗氧化酶活性增加的結果一致。抗氧化酶基因表達量的增加有助於酶活的提高,提示薑黃素可能通過對Mn-SOD和GPx-1基因的調節發揮其抗氧化作用,更詳盡的機製還需進一步深入研究。CAT酶活性僅在高濃度薑黃素作用後略有下降,其基因表達量也無明顯變化,提示在HepG2細胞中CAT的酶活性和表達可能與薑黃素的抗氧化作用無緊密關係。
綜上,薑黃素可以增強HepG2細胞的SOD和GPx酶活性,提高細胞的總抗氧化能力,使細胞中ROS水平下降,Mn-SOD和GPx-1的基因表達上調。薑黃素的抗氧化作用可能是通過調節抗氧化酶的表達和活性實現的,但具體的機理仍有待研究。本研究闡述了薑黃素可能的抗氧化作用機製,可為薑黃素的膳食保健應用提供理論依據及方向引導,但更深入詳細的細胞內薑黃素的生物學功能途徑還有待進一步發掘。
參考文獻
[1]楊長軍,馬雲,李鐵柱,崔群英.薑黃保健功效研究及市場前景分析[J].食品研究與開發,2016,37(06):218-220.
[2] 王涵東, 梁維邦, 薑黃素的研究進展. 江蘇醫藥 2014, 40, 1193-1194.
[3] Authority, E. F. S., Scientific Opinion on the re-evaluation of curcumin (E 100) as a food additive. Efsa Journal 2010, 8, n/a-n/a.
[4] Stig Bengmark,劉青. 植物源保護劑薑黃素的研究進展[J]. 現代藥物與臨床, 2009, 24(01): 22-31.
[5] Choudhuri T , Pal S , Agwarwal M L , et al. Curcumin induces apoptosis in human breast cancer cells through p53-dependent Bax induction[J]. FEBS Letters, 2002, 512(1-3):0-340.
[6] José L Quiles, Mesa M D , César L RamírezTortosa, et al. Curcuma longa extract supplementation reduces oxidative stress and attenuates aortic fatty streak development in rabbits.[J]. Arteriosclerosis Thrombosis & Vascular Biology, 2003, 15(4):173-174.
[7] Trush M A, Kensler T W. An overview of the relationship between oxidative stress and chemical carcinogenesis[J]. Free Radical Biology & Medicine, 1991, 10(3-4):201
[8] 宮芸芸. 氧化損傷與癌症的發生和預防[J]. 國外醫學(衛生學分冊), 2000, (01): 11-14.
[9] 黃真真, 曾瑜, 賈貞超, 張立實, 薑黃素及其衍生物的抗氧化作用研究進展. 預防醫學情報雜誌 2016, 32, 1237-1240.
[10]SREEJAYAN, Rao M N A . Nitric Oxide Scavenging by Curcuminoids[J]. Journal of Pharmacy & Pharmacology, 2011, 49(1):105-107.
[11]李軍,熊琨,龔元,於翔.基於信號轉導通路的薑黃素抗氧化機製研究進展[J].中草藥,2016,47(13):2373-2380.
[12] Dreher D, Junod A F. Role of oxygen free radicals in cancer development[J]. European Journal of Cancer, 1996, 32(1):0-38.
[13] Collins, A., Oxidative DNA damage, antioxidants, and cancer. BIOESSAYS 1999, 21, 238-246.
[14] Holdom, M. D., Lechenne, B., Hay, R. J., Hamilton, A. J., Monod, M., Production and characterization of recombinant Aspergillus fumigatus Cu,Zn superoxide dismutase and its recognition by immune human sera. J CLIN MICROBIOL 2000, 38, 558-562.
[15] Yang, Y., Karakhanova, S., Hartwig, W., D'Haese, J. G., et al., Mitochondria and Mitochondrial ROS in Cancer: Novel Targets for Anticancer Therapy. J CELL PHYSIOL 2016, 231, 2570-2581.
[16] Noto, H., Goto, A., Tsujimoto, T., Noda, M., Cancer risk in diabetic patients treated with metformin: a systematic review and meta-analysis. PLOS ONE 2012, 7, e33411.
[17] Sanchez-Sanchez, B., Gutierrez-Herrero, S., Lopez-Ruano, G., Prieto-Bermejo, R., et al., NADPH oxidases as therapeutic targets in chronic myelogenous leukemia. CLIN CANCER RES 2014, 20, 4014-4025.
[18] Harrison, I. P., Selemidis, S., Understanding the biology of reactive oxygen species and their link to cancer: NADPH oxidases as novel pharmacological targets. Clin Exp Pharmacol Physiol 2014, 41, 533-542.
[19] 曾瑜,劉婧,黃真真,潘興昌,張立實.薑黃素對急性酒精性肝損傷小鼠抗氧化功能的影響[J].衛生研究,2014,43(02):282-285.
崔冬月 李媛媛 肖寶平 劉靜雯 李健 蘇文金 李桂玲
1.集美大學食品與生物工程學院,福建 廈門 361021;1
2.福建省海洋功能食品工程技術研究中心,福建 廈門 361021;
作者簡介:崔冬月(1990-),女,漢族,河北任丘,集美大學,碩士,研究方向:食品營養與基因組學;
*通訊作者:李桂玲(1976-),女,漢族,副教授,集美大學,博士,研究方向:食品營養與基因組學。
基金項目:福建省自然科學基金項目(2017J01447);國家自然科學基金(31771972);海洋功能食品工程技術研究中心開放基金(C11167)
熱點推薦
-

2019《世界杯賽程預測 導刊》雜誌訂閱返百元紅包!
-

世界杯賽程預測 謠言治理的法律分析
-

又一大省連續發生兩起非洲豬瘟疫情!
-
9月大事 | 市場監管總局開展2018年全國“質量月”活動
-

世界杯賽程預測 ,我們怕的是什麼?
-

薑黃素抗氧化的初步機理研究
-

瓜爾膠在食品中的應用
-

保健食品你有在吃嗎?
-

食想,動物蛋白的未來
-

美國雜誌刊登新研究發現 現在的食品都太甜了
-

飲用純淨水≠飲用天然水≠飲用天然礦泉水
-

減少脂肪和糖類吸收——ID-alG™褐藻提取物
-

食品中的甲醛從哪來
-

高糖分飲食難逃患癌風險
-

用“互聯網+”守護舌尖安全
-

飲料世界杯賽程預測 控製要做到這些
-

植物提取物標準促行業規範發展
-

Science子刊:這種常用的食品添加劑,吃太多真的會變胖!
-

依案說法——淺論食用農產品的定性及標簽規定
-

想要世界杯賽程預測 ?先做個有知識的吃貨
-
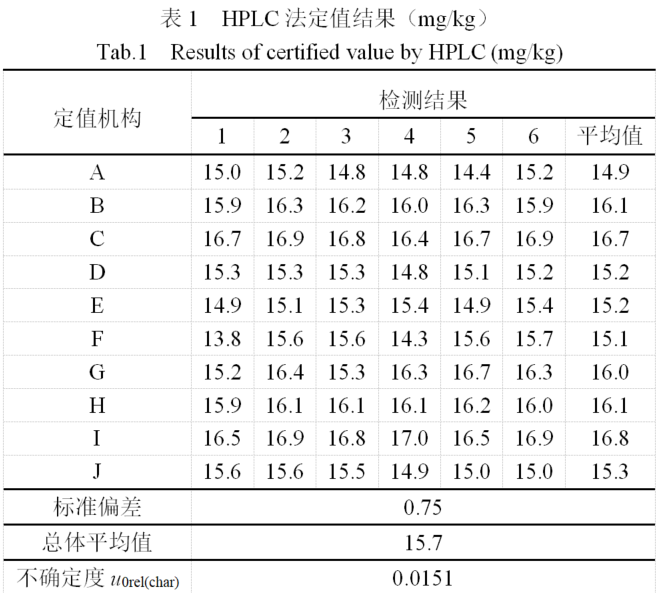
奶粉中維生素B2標準物質的研製
-

高效液相色譜和超高效液相色譜法測定乳製品中三聚氰胺含量的對比
-
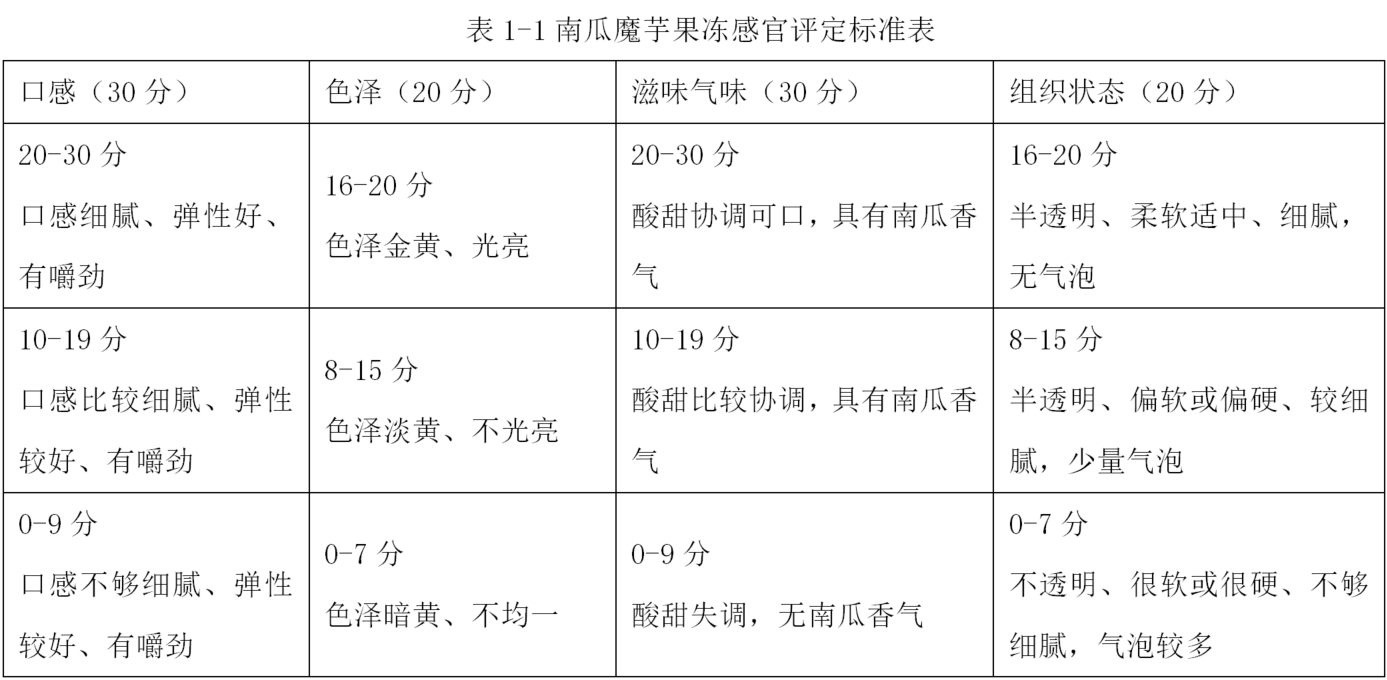
南瓜魔芋果凍的工藝配方研究
-
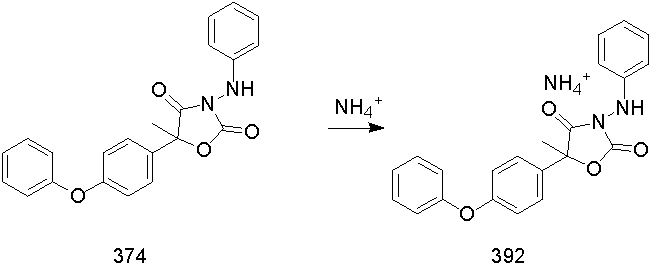
液相質譜測定中離子加合應用的一些研究
-

火爆全網的吐司先生,分分鍾就能饞哭你!
-

收藏這種方法,一鍵解決農殘最多的5樣菜
-

雲南省咖啡生豆主要成分含量調研檢測
-

利用自動定氮儀 快速測定啤酒中的雙乙酰含量
-

淺析不同前處理方法 檢測食品中的重金屬含量
-

嚴誌農:關於近期學校食堂和餐廳世界杯賽程預測 問題的思考與建議





