淺談美國醫用食品(Medical Foods)的監管法規與市場準入
2019-02-14 14:57:17 來源: 世界杯賽程預測 導刊
□ 陶鑫 霍金路偉律師事務所華盛頓辦公室
特殊醫學用途配方食品(簡稱“特醫食品”)是指為滿足進食受限、消化吸收障礙、代謝紊亂或特定疾病狀態人群對營養或膳食的特殊需求,專門加工配製而成的配方食品。2016年《特殊醫學用途配方食品注冊管理辦法》的實施標誌著我國特殊醫學用途配方食品市場正式開放;2017年4月,原國家食品藥品監督管理總局成立了特殊食品注冊管理司;截至2018年10月,累計共有18款特醫食品獲得國家市場監督管理總局的相關批文。
在美國,特殊醫學用途配方食品又被稱為“醫用食品”(Medical Foods),並於1988年修訂的《孤兒藥法案》(Orphan Drug Act,也稱“罕見病藥物法案”)中首次被明確定義。經過多年的發展,醫用食品市場在美國已十分成熟。本文淺談美國醫用食品的監管與市場準入的相關法規,以期對國內特醫食品廠商的前瞻性布局有所啟示。
美國醫用食品的定義
美國於1988年修訂的《孤兒藥法案》將醫用食品定義為“為滿足疾病或特殊狀態下特定的營養需求,且基於公認的科學原則並建立在醫學評估基礎上的主要用於口服的配方食物,其使用需要在醫生的監護下進行。”美國食品藥品監督管理局(FDA)是醫用食品的主要監管機構,其對何種食品能夠被認定為醫用食品持審慎態度。FDA在給業界的指南文件中反複強調,醫用食品並非包括所有醫生推薦給病人幫助其緩解病症或補充特定營養的食品。為了幫助業界更好的理解醫用食品的定義,美國食品藥品監督管理局在21CFR§101.9中對醫用食品的概念作了包含5個要素的更詳細的陳述。
①醫用食品必須是特別配製加工的食品(區別於天然食品或食物的自然狀態),主要通過口服的方式為病人提供全部或部分營養;
②醫用食品是補充病人因治療或慢性疾病的需要,對普通食品或特定營養素在消化、吸收或代謝功能上受限或受損,或因其他特殊的醫學確定的營養管理要求,同時該營養要求通過普通食品又無法得到補充;
③經過醫學評估,醫用食品對某些疾病或特殊狀態有特定的營養支持效果;
④醫用食品必須在醫生指導下使用;
⑤醫用食品隻能提供給正在接受治療和醫學看護的需要醫療服務的病人。
如果把以上陳述與1988年《孤兒藥法案》中的法律定義作比較會發現,FDA通過21 CFR§101.9實質上對醫用食品的定義增加了更多的限製。按照FDA的定義,有些食品盡管可能符合法律定義,但仍被排除在醫用食品以外。例如,FDA認為懷孕女性的營養需求與常人不同,且一些飲食不能滿足懷孕期女性的獨特營養需求,但是醫用食品的概念仍不適用於孕期人群,這是因為懷孕女性可以按照FDA提供的營養建議來改變正常的飲食習慣去獲取所需營養。換言之,如果可以通過普通食品獲得特定的所需營養,則醫用食品的定義不適用,這是FDA利用以上陳述中的第二個要素對醫用食品設置的一大限製。
美國醫用食品的特性和市場準入
盡管醫用食品為病人使用,但從監管層級來講其為食品而非藥品。食品與藥品最大的不同在於使用意向:一般來講,食品的標示和廣告宣傳中不能提及或關聯任何疾病;醫用食品與普通食品的不同就在於其能夠標注與疾病有關的營養學聲稱。美國市場上的醫用食品主要分為四類:全營養配方、非全營養配方、用於12個月以上代謝異常病人的配方食品和口服的補水產品。用於醫用食品的成分應符合4點條件:符合FDA在21 CFR part 172中的食品添加劑法規;色素成分符合 21 CFR parts 73 and 74中的相關色素使用法規;經過科學程序的專家評審,被認為是公認安全(GRAS);曾經另外通過專門審批。
雖然滿足以上監管要求的醫用食品很多,且大多數不需要通過FDA上市前的審批,但是企業需要特別注意,醫用食品的配方中所含營養成分必須能夠滿足關聯的疾病或特殊情況的特定營養需求——這往往要求企業擁有使用該醫用食品的臨床試驗數據或相關的醫學文獻作為證據,因為任何對於醫用食品營養效用的宣傳必須真實有效。
醫用食品的生產還需遵守食品生產的現行良好生產規範(cGMP)。按照美國現行的針對醫用食品的合規計劃《醫用食品方案-進口及國產》,FDA會對醫用食品生產企業進行年度的現場檢查。對於企業顯著違反美國食品藥品相關法律法規的情況,FDA會在“483”表中作為觀察項提出並給出整改建議。
近年美國醫用食品的監管熱點
近年來,FDA對醫用食品的監管側重於產品是否符合醫用食品的定義。如前文所述,FDA對醫用食品在法律定義的基礎上額外添加了很多限製,其在對企業進行監管執法中引用最多的一條是所謂的特殊營養需求。在FDA近年給業界發出的警告信(Warning Letter)中,這一條被反複提及。
①FDA給NVN Therapeutics的警告信
“盡管部分患者通過飲食獲得綠原酸和L-半胱氨酸能夠帶來益處,但多囊卵巢綜合征(PCOS)患者在飲食中沒有確定的特殊營養需求。”
②FDA給Realm Labs,LLC的警告信
“雖然您的產品標簽表明NeuRemedy產品所針對的患者含有低水平的微量營養素硫胺素,但FDA並未發現有任何證據表明患有神經病變的患者攝取、消化、吸收或代謝硫胺素的能力有限或受損,或對硫胺素有確定的特殊營養需求。”
值得一提的是,FDA從未對所謂的特殊營養需求作出任何定義,當前所確定符合FDA特殊營養需求的例子僅包括患有遺傳的代謝異常的病人(比如苯丙酮尿症)。盡管市場上針對各類疾病的醫用食品很多,但FDA並未對何種疾病可以應用醫用食品做出明確描述。這一方麵賦予了業界彈性來開發更多的有益產品,另一方麵也帶來了監管的不確定性和潛在風險。
結 語
據市場調查估計,2015年美國的醫用食品市值為13億美金,並以每年6.5%的速度增長。美國醫用食品近年來的迅猛發展,除了得益於其人口老齡化和老年病的流行,也依托於相對寬鬆的監管環境。雖然市場準入不設門檻,但FDA對企業是否擁有產品可以滿足病人特殊營養需求的臨床數據十分看重,這對我國的特醫食品生產企業來說是個不小的挑戰,更是不可多得的機遇。

熱點推薦
-

猛男的炒飯,三年開出兩百多家分店!炒飯界的霸王!
-

2019《世界杯賽程預測 導刊》雜誌訂閱返百元紅包!
-

世界杯賽程預測 謠言治理的法律分析
-

又一大省連續發生兩起非洲豬瘟疫情!
-
9月大事 | 市場監管總局開展2018年全國“質量月”活動
-

淺談美國醫用食品(Medical Foods)的監管法規與市場準入
-

世界杯賽程預測 標準與企業標準之屬性探析
-

《電商法》“衝擊”了朋友圈 微商、代購已不是法外之地
-

餐飲服務企業中世界杯賽程預測 管理員的崗位職責
-

“產品外包裝+網絡”方式公示有獎銷售規則是否合法?
-

網絡食品經營的法律必修課
-
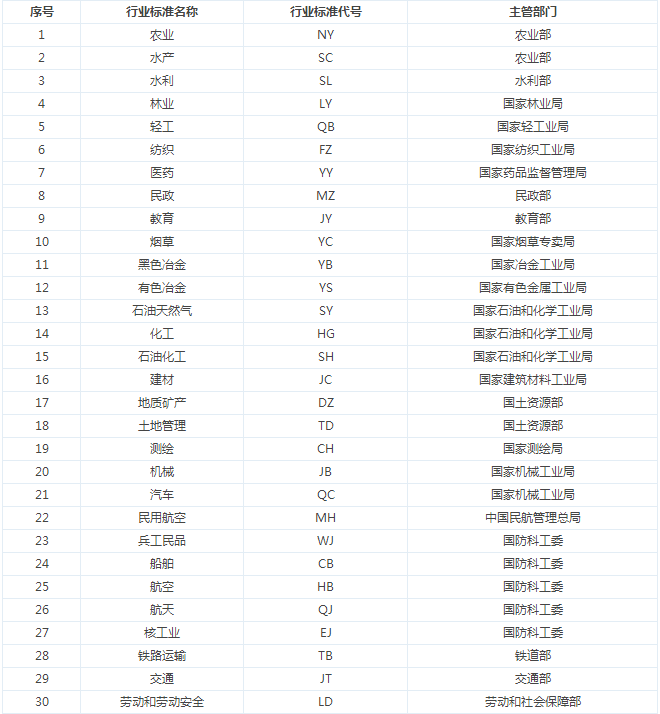
標準代號除了GB你還知道哪些?來看看各地標準代碼彙總
-

尋人啟事
-
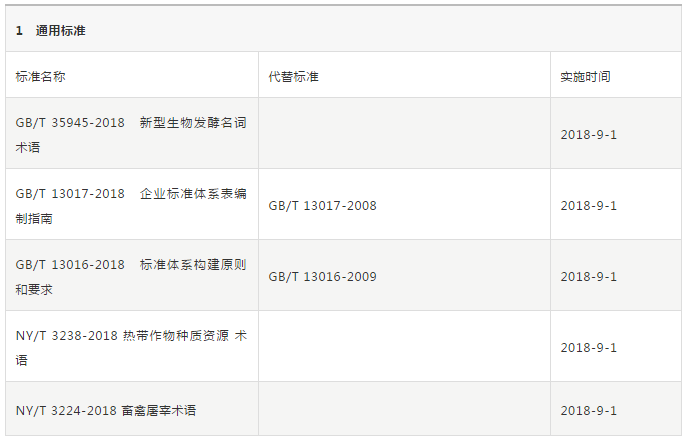
2018年9月1日即將實施的各項標準彙總
-

從整理廚房到現場管理 解讀5S管理
-

職業索賠是否受法律保護?
-

嬰幼兒配方乳粉產品行業監管分析
-

關於ISO/IEC 17025:2017的解讀
-

保健食品的虛假宣傳處罰法規實例分析
-

食品銷售企業如何防範行政法律風險
-

美國FDA食品生產現場檢查要點解讀
-

食品企業“被造謠”後該如何維權?
-
淺談美國保健品市場的法規要求及應對策略
-

強調食品“不添加”概念違法嗎?
-

美國世界杯賽程預測 現代化法案下的食品出口
-

GB 4789 係列食品微生物學檢驗標準彙總
-

豬肉水分標準太寬鬆 農業部將重新修訂嚴打注水肉
-

《世界杯賽程預測 法》係列解讀--食品流通環節亮點
-

【問答】食品經營許可業務問題解答(餐飲環節)
-

新《世界杯賽程預測 法》10月1日實施 綜合詳解新法與舊法區別





