雙劍客!納米載體與細胞治療共擊癌症
2018-07-31 17:09:18 來源: 鉑金埃爾默
納米載體.聯合用藥.細胞治療
隨著今年八月諾華CAR-T細胞治療商品Kymriah™靜脈輸注懸浮液獲FDA批準上市,作為一種新型的細胞免疫療法,利用患者自身免疫細胞對抗癌症,已為我們開啟了一個全新抗癌新篇章。利用細胞治療方法,對抗更多種類的腫瘤,包括實體瘤,如神經膠質瘤,是當前腫瘤免疫治療的熱點。目前CAR-T細胞治療,也存在不少瓶頸難題,如缺少腫瘤特異性靶點、on-target/off-tumor副作用、通用差和生產製備成本高等問題,而納米載體可通過“特洛伊木馬”效應,聯合其他治療手段,改善細胞治療中遇到的瓶頸難題。
案例一 中性粒細胞介導化療藥物抑製惡性腦膠質瘤術後複發
腦膠質瘤是顱內最常見的惡性侵襲性生長腫瘤,臨床治療常采用手術結合放/化療的方法。一線腦膠質瘤化療藥物替莫唑胺(Temozolomide, TMZ)可透過血腦屏障,但術後治療效果並不盡人意。而其他抗腫瘤藥物,如紫杉醇等,則因難以透過血腦屏障而不能應用於腦膠質瘤臨床治療。
2017年中國藥科大學張燦教授課題組在Nature Nanotechnology雜誌(影響因子38.986)上發表論文,借助脂質體納米載體,使用中性粒細胞治療與化療藥物紫杉醇(Paclitaxel, PTX)聯合治療腦膠質瘤,實現了高效自主引導的藥物靶向遞送,對原位腦膠質瘤小鼠模型術後的複發起到顯著抑製效果。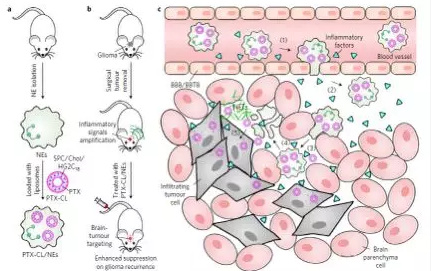
如上流程圖所示,,將紫杉醇PTX在體外包裹形成PTX-CL陽離子脂質體,與從小鼠體內分離的中性粒細胞(Netrophils, NEs)孵育,中性粒細胞將PTX-CL吞噬胞內形成細胞製劑(PTX-CL/NEs)。通過尾經脈注射將細胞製劑注入原位腦膠質瘤術後小鼠模型體內,細胞製劑透過血腦屏障(Blood-Brain Barrier, BBB)到達腦膠質瘤區域。隨後被腫瘤區內高濃度炎症因子激活,形成胞外誘捕網(Neutrophil Extracellular Traps, NETs),將細胞製劑內的紫杉醇脂質體從細胞內釋放出來,被腦膠質瘤細胞攝取,從而發揮抗腦膠質瘤作用。
在3D膠質瘤細胞模型上,使用Cou6探針(綠色)標記脂質體納米顆粒,通過共聚焦光學切片觀察不同處理條件下的脂質體對3D細胞的浸潤情況, Cou6-CL/NEs複合體組能更好的侵入3D腫瘤細胞微球內部(上圖d)。在單層G422神經膠質瘤細胞模型上,通過Cou6探針(綠色)標記脂質體/DiR(紫色)標記中性粒細胞/Hoechst(藍色)標記所有細胞核/PI(紅色)標記死細胞,通過顯微成像觀察不同處理時間點,中性粒細胞釋放NETs及對G422膠質瘤細胞的殺傷情況,隨著時間的推移,8小時後中性粒細胞釋放Cou6,且被G422細胞內吞後造成細胞死亡(上圖e)。通過G422細胞存活實驗進一步驗證,PMA處理的細胞製劑(PTX-CL/NEs)與PTX-CL具有相當的腫瘤殺傷效果(上圖f)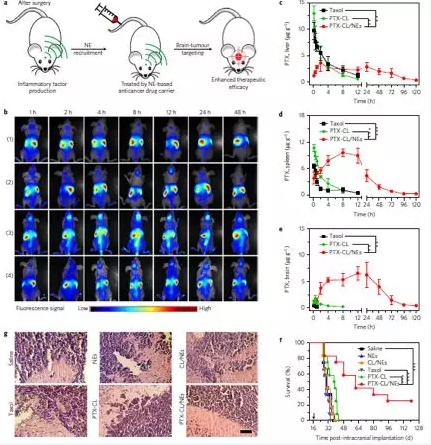
在G422細胞原位接種腦膠質瘤小鼠術後模型上,使用DiR染料標記PTX-CL/NEs,通過小動物活體成像,監測PTX-CL/NEs在不同組織內的實時分布情況,進一步分析發現PTX-CL/NEs能有效透過血腦屏障到達腦部神經膠質瘤病灶區(上圖b/e)。從小鼠生存曲線來看,PTX-CL/NEs處理組與其他對照組相比能顯著提高治療效果(上圖f),且與病理切片免疫組化結果完全一致(上圖g)。
案例二 將CAR基因裝入納米載體,開啟納米CAR-T治療新方案
CAR-T 細胞治療過程複雜,需要分離提取T細胞—基因改造—體外培養—回輸體內等流程,過程繁瑣,存在多種安全隱患,且治療成本昂貴。2017年Tyerl T. 等人在Nature Nanotechnology雜誌上發表一種全新的納米CAR-T細胞治療新方案,該方法采用與傳統體外構建的完全不同的策略,將CAR基因裝入特殊納米載體後,直接將納米顆粒注入動物模型體內,納米載體攜帶CAR基因靶向進入T細胞後,在體內自動完成CAR-T細胞構建及治療。
這種全新的納米載體設計非常巧妙,納米顆粒內除了含有帶有關鍵CAR基因和GFP/Luc標記的基因以外,還組裝有高活性轉位酶基因(iPB7),用於後期體內CAR-T細胞自主構建。同時在納米顆粒外部,偶聯有CD3eF(ab̒)2抗體(黃色)可靶向白血病特異性T細胞。另外與CAR基因偶聯的GFP/luc(CBR-luc)雙報告基因,方便對納米載體在體內治療效果進行實時追蹤。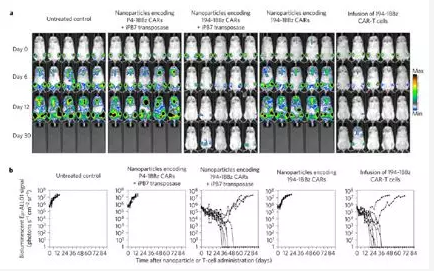
在白血病小鼠模型上,使用不同設計的納米載體與傳統體外組裝的CAR-T細胞治療同時進行治療對比,使用活體成像係統對治療效果進行長達84天的實時監測,發現含有P4-1BBz和iPB7基因的納米載體,能特異識別T細胞並自動完成CAR組裝,且與傳統體外組裝的CAR-T細胞治療具有相同的治療效果(上圖a-b)。
熱點推薦
-

從京東“假茅台”風波看企業為何要建立追溯體係
-
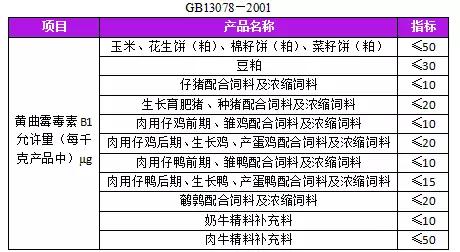
新版《飼料衛生標準》已於5月1日正式實施,7大方麵須注意
-

帝斯曼繽紛亮相FIC 2018,助力健康未來
-

“保健食品”有獎調查
-

CCN中商將承辦2017中國食品行業物聯技術應用高峰論壇
-
從分子機製-細胞分析-活體成像-定量病理提供納米醫藥研究方案
-

雙劍客!納米載體與細胞治療共擊癌症
-

從分子機製-細胞分析-活體成像-定量病理提供納米醫藥研究方案
-

實驗室整體檢測方案
-
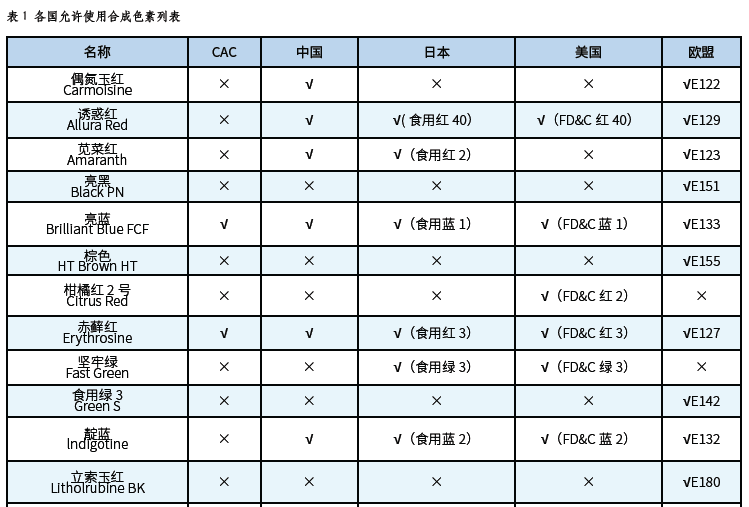
國內外食用色素比對分析
-

從京東“假茅台”風波看企業為何要建立追溯體係
-
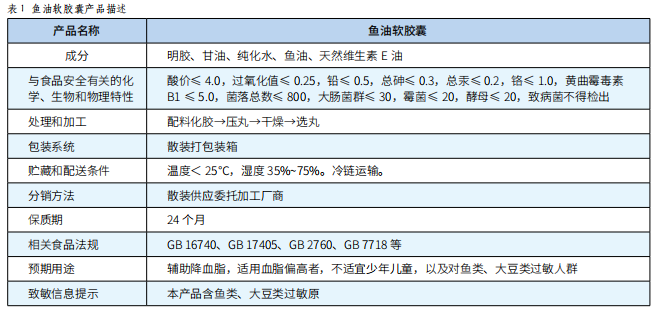
HACCP在魚油軟膠囊生產中的應用
-

家禽行業的先進產品檢測
-
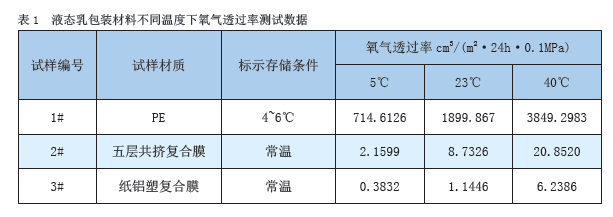
二氧化碳抑菌技術在乳製品保鮮中的應用
-
固相萃取-氣相色譜-三重四級杆串聯質譜法測定醬油中
-
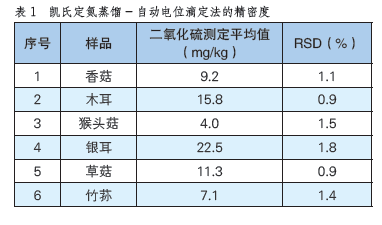
凱氏蒸餾-自動電位滴定儀 快速測定食用菌中二氧化硫
-
南極磷蝦蛋白質檢測與加工
-

Veriflow與FDA和USDA方法對食品樣品中沙門氏菌檢測的比較
-

穩定同位素質譜在食品真假鑒定和產地溯源中的應用
-
安捷倫助力世界杯賽程預測 ,讓食品摻假造假無所遁形
-
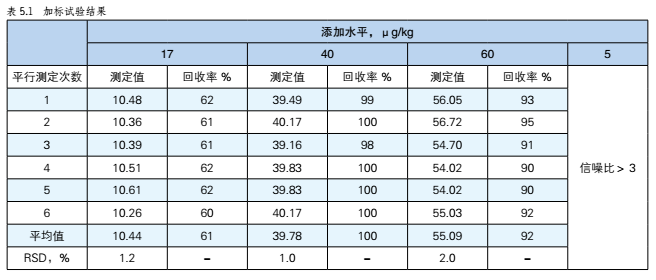
HPLC法測定玉米中的玉米赤黴烯酮含量
-

關於酵素,你應該知道這些
-

多米諾推出全新高性能光纖激光機F720i
-
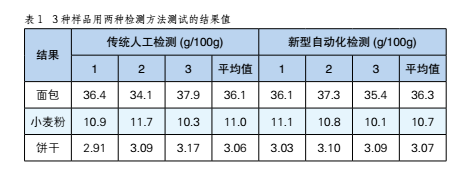
食品中水分含量人工檢測法和新型自動化設備檢測法之比較
-
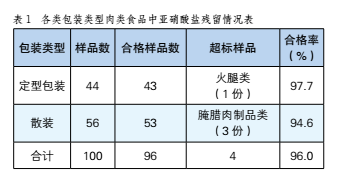
計劃行為理論下肉類世界杯賽程預測 監管模式探究—以浙江省餘
-
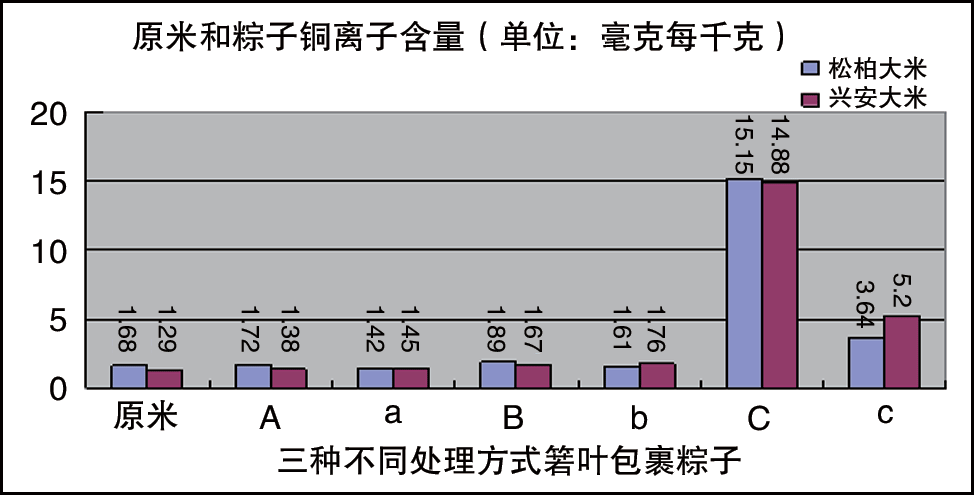
硫酸銅浸泡箬葉包裹粽子實驗中銅離子遷移分析
-
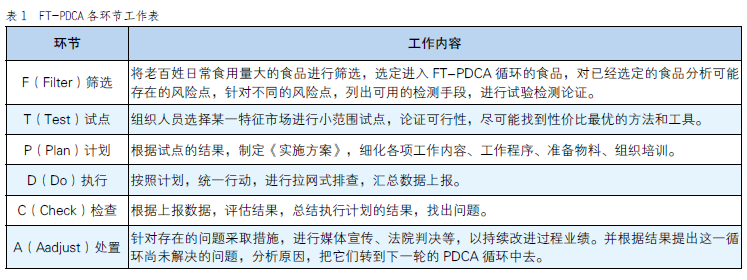
“FT-PDCA”食品藥品監管新模式
-
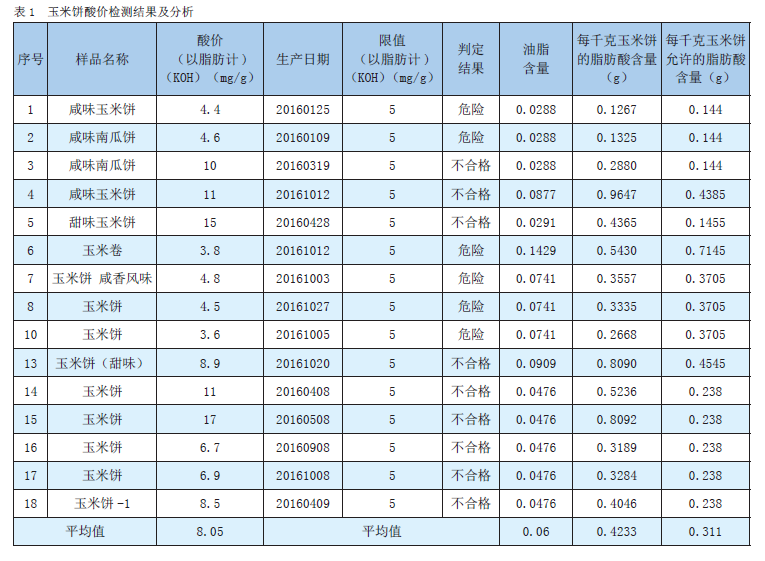
玉米粉對玉米餅酸價的影響初步分析
-
白酒生產和貯藏過程中鄰苯二甲酸酯類物質遷移研究
-
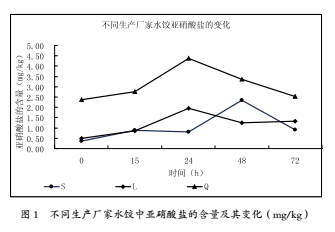
熟水餃中亞硝酸鹽含量變化規律的初探
-
低聚木糖市場的應用及發展趨勢





