嬰幼兒配方乳粉產品行業監管分析
2018-04-25 21:26:46 來源: 世界杯賽程預測 導刊
□ 謝佳岐 徐嵐 霍金路偉律師事務所北京辦公室
□ 陶鑫 霍金路偉律師事務所華盛頓辦公室
近年來,嬰幼兒配方乳粉產品一直是社會公眾和監管機構關注的焦點。自“三聚氰胺奶粉”事件以來,嬰幼兒配方乳粉行業發生了巨大且深刻的變革,中國監管機構也在通過不斷製定嚴格的監管法規來重新建立國人對嬰幼兒配方乳粉產品的信任,如何提升自我來應對日益完善的監管環境也成為嬰幼兒配方乳粉產品企業所關心的問題。
美國FDA對乳粉產品的監管
在回顧近期中國乳品行業監管政策的重大變革前,不妨先來談談美國食品藥品監督管理局(FDA)是如何對乳粉產品實行市場監督的。因為乳粉產品是人類敏感的嬰幼兒期最重要的、甚至是唯一的營養來源,故美國聯邦食品、藥品和化妝品法案對乳粉的配方和生產都提出了比一般食品更嚴格的標準;具體來說,所有在美銷售的嬰幼兒乳粉必須符合FDA對29種營養物質製定的最低標準和對9種營養物質製定的最高標準。嬰幼兒乳粉的生產也必須符合21 CFR Part 106中的良好生產管理規範。盡管FDA並未要求生產企業對產品進行配方注冊,但如果企業是第一次生產嬰幼兒乳粉,或者其乳粉產品經過了重大變更,FDA則要求企業在產品上市的90天前於監管機構進行備案並遞交產品合規的分析報告,產品備案中應包含配方的具體信息、對產品生產變更的描述和企業對於其產品質量規範合規的聲明。FDA會對乳粉生產企業進行每年一次的現場檢查,在檢查中,FDA會提取乳粉樣品用於分析。不符合法定營養標準或含有致病微生物的乳粉將被判定為法律意義上的摻雜或摻假,FDA有權利對這些違規乳粉產品實施強製性的市場召回。
我國嬰幼兒配方乳粉產品的改革演變
在完善嬰幼兒配方乳粉產品監管體係的呼聲中,2015年10月1日實施的新《中華人民共和國 世界杯賽程預測法》作出了明確的規定,嬰幼兒配方乳粉的產品配方應當經國家食品藥品監督管理總局注冊。這標誌著嬰幼兒配方乳粉產品從此走向配方注冊製時代,中國也成為首個實行嬰幼兒乳粉配方注冊製度的國家。此後3年,食藥監總局陸續出台了一係列實施細則和辦法,從實踐層麵深化了整個嬰幼兒配方乳粉產品監管體係。
2016年6月26日,食藥監總局公布的《嬰幼兒配方乳粉產品配方注冊管理辦法》(以下簡稱“《辦法》”)正式建立了嬰幼兒配方乳粉的注冊體係。所有在中國境內銷售的嬰幼兒配方乳粉產品,無論是境內生產或是境外產品進口(包括跨境電商銷售),都要逐步納入到注冊體係的監管範疇內。但基於當時市場交易和政策過渡,食藥監總局相繼出台了多個規定,給予了生產商過渡的時間。
值得注意的是,2018年1月1日起,嬰幼兒配方乳粉產品配方注冊管理過渡期大部分已結束。除了跨境電商零售以外,其餘所有在中國境內銷售的嬰幼兒配方乳粉產品均受到配方注冊製的嚴格管製。而通過跨境電商零售渠道銷售的嬰幼兒配方乳粉產品在2018年12月31日前都處於寬限期,等待相關政策的出台。截至目前,除了境外生產企業2018年1月1日前生產的嬰幼兒配方乳粉可在未獲得配方注冊的情況下繼續銷售至保質期外,其餘境內生產或境外生產進口的嬰幼兒配方乳粉產品均不得銷售。
配方注冊製的關鍵特點
一是產品範圍較廣。在中國境內銷售的所有嬰幼兒配方乳粉產品,包括境內生產或境外生產進口的產品都需要進行配方注冊,並且跨境電商銷售也將逐漸被納入監管範圍。這意味著中國市麵上所有可能接觸到的嬰幼兒配方乳粉產品都將進入監管部門的管控範疇,體現了配方注冊製實施的廣度。
二是對將配方的配額實施嚴格的控製。針對嬰幼兒配方乳粉產品配方繁多的亂象,《辦法》規定,每個企業原則上不得注冊超過3個配方係列,9種產品配方,但是這並不意味著生產商的配方受到了嚴重的衝擊從而影響產品銷售。從食藥監總局公布的公開信息中可以發現,許多同一集團公司和旗下的子公司均分別成功獲得超過9個配方的注冊,這意味著同一集團公司的子公司獨立享有配方配額。並且《辦法》還規定同一集團公司的全資子公司可以使用集團公司內另一全資子公司已經注冊的嬰幼兒配方乳粉產品配方。但需滿足的是,使用配方的子公司之前已經獲得嬰幼兒配方乳粉產品配方注冊及生產許可,且已有生產該配方所需的工藝、主要設備設施等條件,以及集團公司應當提前向食藥監總局提交書麵報告且應對所提交材料的真實性負責,生產行為應符合法律法規的要求,產品標簽應如實標注實際生產者的名稱和地址。這表明監管機關隻是嚴格管理配方的科學性和安全性,並沒有過度地限製廠商的市場空間。
三是國際品牌和國產品牌占比較為均衡。截至2018年1月1日,食藥監總局共批準了130家企業的952個配方,其中境內93家企業、743個配方,境外37家企業、209個配方。由於境內企業較多含有外商投資背景,意味著配方注冊製並未導致國際品牌在中國市場的衰落,而是兩者處於較為均衡的狀態。
四是生產商的現場核查製度。《辦法》規定食藥監總局需根據實際需要對包括境外申請人在內的申請人進行現場核查,並且陸續出台了《嬰幼兒配方乳粉產品配方注冊現場核查要點及判斷原則(試行)》。但是,目前食藥監總局公布的公開信息中尚未明確對於開展境外核查的程序規範。作為配方注冊製實施的初期,境外現場核查製度尚未真正落實,但是隨著整個監管體係的落地,境外現場核查製度也將逐漸發揮其監管的突擊性,這無疑會給行業參與者帶來更多靈活的管控和監督。
特殊醫學用途嬰幼兒配方乳粉的現狀
近期,隨著絕大多數嬰幼兒配方乳粉產品配方注冊的落地,特殊醫學用途嬰兒配方乳粉的注冊也引起了廣泛關注。特殊醫學用途嬰兒配方乳粉是針對特殊醫學狀況嬰兒的乳粉,例如早產兒或低出生體重嬰兒以及氨基酸代謝障礙的嬰兒,特殊醫學用途嬰兒配方乳粉提供的能量和營養成分能夠滿足此類嬰幼兒生長發育的需求。2016年我國出台了《特殊醫學用途嬰兒配方注冊管理辦法》,針對特殊醫學用途嬰兒配方乳粉的注冊有了明確的規定。近期,根據食藥監總公布的公開信息,境外生產商和國內乳企也相繼獲得特配食品配方的注冊批文,這也意味著市場上特殊醫學用途嬰兒配方乳粉的審批也走向常態化,避免了因為配方注冊製實施而導致的該類乳粉的短缺。
規範嬰幼兒配方乳粉產品標簽標識
除了配方注冊製的合規需求,規範標簽標識也成為了監管部門關注的重點。《辦法》要求,申請人申請配方注冊時要一並提交標簽和說明書樣稿及標簽、說明書中聲稱的說明、證明材料,並對標簽和說明書表述要求做出細致規定。這意味著生產商在宣傳其產品時必須謹慎使用宣傳用語。
根據食藥監總局2017年12月15日公布的《嬰幼兒配方乳粉標簽標識監督檢查和整改規範的通告》,在其部署開展為期一年的嬰幼兒配方乳粉標簽標識規範和監督檢查工作中,食藥監總局共檢查生產企業126家/次、經營單位21.1萬家/次,立案查處253起,下達責令整改通知書5604餘份。並且針對具體問題進行了詳細說明,產品名稱含有具有誤導消費者的“金裝”、“金牌”等字樣或者標簽標注的原輔料來源使用了“全進口奶源”、“源自天然牧場”、“生態牧場”等模糊信息,以及明示或者示具有益智、增加抵抗力或者免疫力、保護腸道等功能性表述都將成為整改的對象。這也提醒生產商要客觀、謹慎地使用宣傳語言以避免監管部門的整改。
專家介紹:
 陶鑫律師(Xin Tao)是Hogan Lovells華盛頓辦公室的資深律師,其執業領域側重於美國的食品藥品法。憑借對美國監管係統的深刻了解以及自身的生物化學背景,陶鑫律師曾助力多家食品、保健品及藥品公司製定產品出口及上市的合規策劃,並幫助企業應對政府調查。陶鑫律師同時參與主導了多個食品藥品公司兼並收購的海外盡職調查。
陶鑫律師(Xin Tao)是Hogan Lovells華盛頓辦公室的資深律師,其執業領域側重於美國的食品藥品法。憑借對美國監管係統的深刻了解以及自身的生物化學背景,陶鑫律師曾助力多家食品、保健品及藥品公司製定產品出口及上市的合規策劃,並幫助企業應對政府調查。陶鑫律師同時參與主導了多個食品藥品公司兼並收購的海外盡職調查。
專家介紹:
 謝佳岐律師是霍金路偉律師事務所北京辦公室資深律師,專注於食品、藥品、醫療器械和化妝品領域,其經驗涉及此領域內各種監管事宜。謝律師熟悉產品審批、臨床試驗、不良實驗報告、產品召回、標簽、廣告要求,以及遵守中國有關本地製造和全球分銷的法律法規。謝律師為美國多家頂級醫療集團在中國合資設立醫院或提供管理服務等事宜提供法律服務。
謝佳岐律師是霍金路偉律師事務所北京辦公室資深律師,專注於食品、藥品、醫療器械和化妝品領域,其經驗涉及此領域內各種監管事宜。謝律師熟悉產品審批、臨床試驗、不良實驗報告、產品召回、標簽、廣告要求,以及遵守中國有關本地製造和全球分銷的法律法規。謝律師為美國多家頂級醫療集團在中國合資設立醫院或提供管理服務等事宜提供法律服務。
專家介紹:
 徐嵐律師是霍金路偉律師事務所北京辦公室食品、生命科學和醫療團隊的律師助理。徐律師曾為外國食品公司在華設立實體提供法律服務。徐律師還曾為多家生命科學公司在華監管事宜等提供谘詢服務。
徐嵐律師是霍金路偉律師事務所北京辦公室食品、生命科學和醫療團隊的律師助理。徐律師曾為外國食品公司在華設立實體提供法律服務。徐律師還曾為多家生命科學公司在華監管事宜等提供谘詢服務。
熱點推薦
-

又一大省連續發生兩起非洲豬瘟疫情!
-
9月大事 | 市場監管總局開展2018年全國“質量月”活動
-

世界杯賽程預測 ,我們怕的是什麼?
-

從京東“假茅台”風波看企業為何要建立追溯體係
-
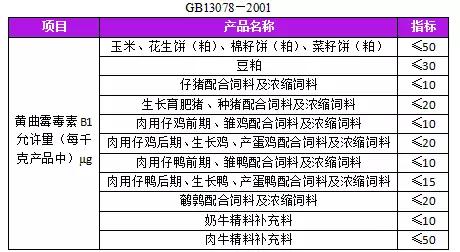
新版《飼料衛生標準》已於5月1日正式實施,7大方麵須注意
-
世界杯賽程預測 法:禁止分裝生產嬰幼兒配方乳粉 允許貼牌
-
食藥總局解讀嬰幼乳粉"新政"有關配方注冊製的15問
-
中國嬰幼兒配方奶粉將出台新規
-

尋人啟事
-
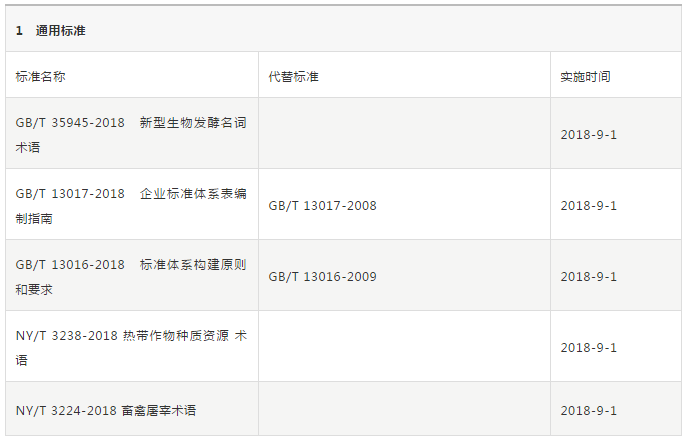
2018年9月1日即將實施的各項標準彙總
-

從整理廚房到現場管理 解讀5S管理
-

職業索賠是否受法律保護?
-

嬰幼兒配方乳粉產品行業監管分析
-

關於ISO/IEC 17025:2017的解讀
-

保健食品的虛假宣傳處罰法規實例分析
-

食品銷售企業如何防範行政法律風險
-

美國FDA食品生產現場檢查要點解讀
-

食品企業“被造謠”後該如何維權?
-
淺談美國保健品市場的法規要求及應對策略
-

強調食品“不添加”概念違法嗎?
-

美國世界杯賽程預測 現代化法案下的食品出口
-

GB 4789 係列食品微生物學檢驗標準彙總
-

豬肉水分標準太寬鬆 農業部將重新修訂嚴打注水肉
-

《世界杯賽程預測 法》係列解讀--食品流通環節亮點
-

【問答】食品經營許可業務問題解答(餐飲環節)
-

新《世界杯賽程預測 法》10月1日實施 綜合詳解新法與舊法區別
-

新 《世界杯賽程預測 法》 落地需配套製度
-

世界杯賽程預測 最嚴處罰有多嚴:罰款提到三十倍
-

食品廣告發布新規:明星代言保健食品廣告擬被禁止
-

運用法治思維引導世界杯賽程預測 社會共治
-
風險交流在新世界杯賽程預測 法中的地位
-
新世界杯賽程預測 法體現嚴懲重處
-

《國家標準·預包裝食品標簽通則》GB 7718-2011標準圖文解讀





