動物源性食品鴨血中鴨成分普通PCR檢測方法探究
2018-03-27 12:17:52 來源: 世界杯賽程預測 導刊
摘要:研究鴨血因DNA部分降解而使普通PCR檢測結果偏離的優化方法。對普通PCR方法未檢出但實時熒光定量PCR方法檢出的鴨血DNA通過增加擴增模板量到5uL,擴增產物稀釋100倍進行二次擴增,可以得到的DNA純度較高,凝膠電泳條帶明亮,背景清晰,改進的方法能使普通PCR方法檢測結果準確性提高,降低假陰性概率。
關鍵詞:鴨血,普通PCR檢測,假陰性,鴨血DNA,二次擴增
鴨血的營養價值很高,含有豐富的蛋白質、多種微量元素(如鐵、銅、鈣等),有補血和清熱解毒的作用,並有預防和治療缺鐵性貧血的功效。鑒於如此的食用功效,且鴨血液量相對於體積龐大的動物血量相對較少,因此鴨血的價格明顯偏高,部分商家為了盈利可能會在鴨血中摻雜豬血甚至其他動物血來銷售。以DNA為基礎的PCR技術廣泛被用來鑒定食品中的動物源性成分[1],由於血液保質期短,在加工製作的過程中會加入鹽和凝固劑[2]等化學物質,加之在提取鴨血DNA過程中的物理作用等會對DNA造成破壞,使DNA含量降低而使檢測結果有偏差。
目前檢測鴨成分的方法有普通PCR法和實時熒光定量PCR法,國家檢測鴨成分的唯一標準SN/T 3731.5-2013《食品及飼料中常見禽類品種的鑒定方法第5部分:鴨成分檢測PCR法》是用普通PCR法,實時熒光定量PCR法是不同的試劑盒公司開發出來的用於科研用方法,暫無實時熒光定量PCR法檢測鴨成分的國家檢測標準。熒光定量PCR在靈敏度、準確度、便捷性上均高於普通PCR,但對於需要出具第三方檢測報告的單位和企業,隻能用國家標準進行檢測,本文對SN/T 3731.5-2013檢測鴨血樣品中鴨成分因鴨血DNA部分降解而導致結果偏離進行了方法優化探索,以提高檢測結果的準確性。
材料與方法
材料與試劑鴨血:購自南京某大型超市。
DNA提取試劑盒TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver 5.0、TaKaRa Taq(5U/uL)、10×PCR Buffer(Mg2+plus)、dNTP Mixture(各2.5mM)、PCR體係預混液Premix Ex TaqTM(Probe qPCR)寶生物工程(大連)有限公司。
儀器和設備:EPS 300電泳儀Tanon;Universal GenoSens1800凝膠成像儀:上海勤翔;ABI 2720普通PCR儀:美國賽默飛;PikoREAL 96實時熒光定量PCR儀(96孔板):美國賽默飛。
引物:參照標準[3]合成擴增鴨源性成分的引物,引物序列見標準[3]表1。引物由寶生物工程(大連)有限公司合成。
DNA提取方法:鴨血DNA提取方法按照DNA提取試劑盒的方法步驟進行提取。
普通PCR檢測:鴨血中鴨成分檢測步驟見SN/T 3731.5-2013[3]。
實時熒光定量PCR檢測:將鴨血所提DNA進行鴨源性成分的實時熒光定量PCR檢測,PCR反應體係為:預混液20μL,包括DNA模板1.6uL,Premix Ex TaqTM(Probe qPCR)10uL,上下遊引物各0.4uL,Probe 0.8uL,加ddH2O補足20uL。
鴨成分實時熒光定量PCR反應條件為:95℃預變性30s;PCR反應:95℃5s,60℃30s,進行40個循環。根據擴增曲線Ct值≤35視為檢出鴨成分。
增加模板進行擴增檢測:將鴨血DNA添加不同模板量進行擴增,即PCR反應體係中DNA模板分別添加1uL、2uL、5uL、10uL,反應體係和反應條件見SN/T 3731.5-2013[3]。擴增產物進行電泳檢測。
二次擴增:將1.7擴增後的產物取2uL加入98uL ddH2O進行100倍稀釋,取1ul作為模板進行二次擴增,反應體係和反應條件見SN/T 3731.5-2013[3]。擴增產物進行電泳檢測。
結果與分析
鴨血樣品普通PCR和實時熒光定量PCR檢測結果:對提取的鴨血DNA利用鴨源性引物進行PCR擴增,反應產物經瓊脂糖凝膠電泳檢測擴增結果,結果見圖1。對提取的鴨血DNA利用鴨源性引物進行實時熒光定量PCR,結果見圖2。
由圖1可知,空白對照和陰性對照無條帶產生,陽性對照在226bp有條帶產生,鴨血DNA擴增後在226bp位置無可見條帶,未檢出鴨成分。由圖2可知,實時熒光定量PCR檢測結果空白對照和陰性對照均為未檢出,陽性對照Ct值分別為18.26,檢出鴨成分,鴨血兩個平行樣Ct值分別為23.21/23.95,檢出鴨成分。普通PCR與實時熒光定量PCR檢測結果不一致,可以推測鴨血中鴨DNA可能受物理、化學等因素的影響,核酸有降解。

由圖3可以看出,添加鴨血模板量1uL、2uL、5uL、10uL,每個模板梯度各2個平行樣,擴增後都是Smear,陽性對照條帶正常而且很亮,排除了反應體係及引物的原因。因為鴨血與鴨肉不同,血液的保存期短,儲存不了太長時間,基因組降解可能性大。
二次擴增檢測結果:由圖4可以看出,對鴨血DNA添加不同模板量1uL、2uL、5uL、10uL擴增後的產物,經過1.8步驟進行二次擴增後,空白對照和陰性對照無條帶產生,陽性對照在226bp有條帶產生,不同模板添加量1uL、2uL、5uL、10uL二次擴增的擴增產物,2uL模板添加量在226bp位置有弱條帶,5uL和10uL模板添加量在226bp位置有明亮條帶,無非特異性條帶,擴增結果良好。
通過增加模板DNA量至5uL後擴增,可以增加目的DNA的含量,通過稀釋後,可以降低雜質的含量從而增加目的DNA的含量,提高擴增目的DNA的準確度。目前普通PCR法是國家現有的檢測鴨成分的唯一標準方法,是需要出具正式檢測報告的檢驗檢測機構的唯一檢測方法,而普通PCR法有很大的局限,檢測結果不夠準確,如果單以SN/T 3731.5-2013方法檢測鴨源性成分,可能得到錯誤的檢測結果,因此通過此優化方法來優化檢測過程,可以提高檢測結果的準確度,可為質檢部門及第三方檢測機構推廣應用,作為實驗室檢測血液類食品的常規檢測手段。
參考文獻
[1]全國文獻工作標準化技術委員會.SN/T 1119-2002進口動物源性飼料中牛羊源性成分檢測方法-PCR方法[S].北京:中國標準出版社,2002.
[2]邵碧英,楊婕,張體銀.動物產品的DNA提取方法[J].畜牧與獸醫,2005,37(9):47-49.
[3]中華人民共和國國家質量監督檢驗檢疫總局.SN/T 3731.5-2013食品及飼料中常見禽類品種的鑒定方法-第5部分:鴨成分檢測-PCR法[S].北京:中國標準出版社,2013.
徐慧馬慧娟
作者簡介:
徐慧,碩士研究生,高級工程師,實驗室技術負責人,江蘇省理化測試中心。
馬慧娟,江蘇省理化測試中心。
熱點推薦
-

從京東“假茅台”風波看企業為何要建立追溯體係
-
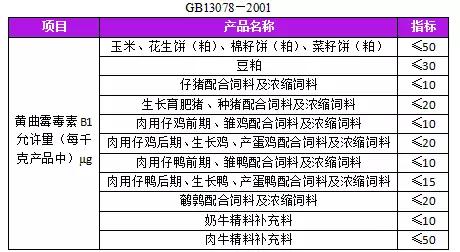
新版《飼料衛生標準》已於5月1日正式實施,7大方麵須注意
-

帝斯曼繽紛亮相FIC 2018,助力健康未來
-

“保健食品”有獎調查
-

CCN中商將承辦2017中國食品行業物聯技術應用高峰論壇
-
顯齒蛇葡萄葉有效成分的提取工藝研究
-
烘焙必藏 植物性奶油與動物性奶油的那些事兒,史上最全!
-

“人道屠宰”啥東東?世界動物保護組織來給掃掃盲...
-
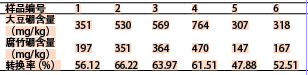
大豆及其製品(腐竹)中硼 含量轉換情況考察
-

高效液相色譜-質譜聯用儀同時測定飲料 中甜蜜素等檢測方法
-

正交試驗設計在優化釀酒酵母 培養條件中的應用
-

國家為什麼要做世界杯賽程預測 抽檢?
-
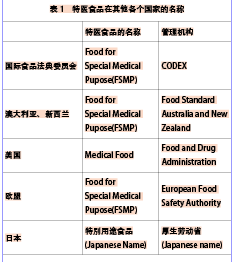
特殊醫學用途配方食品現狀綜述
-
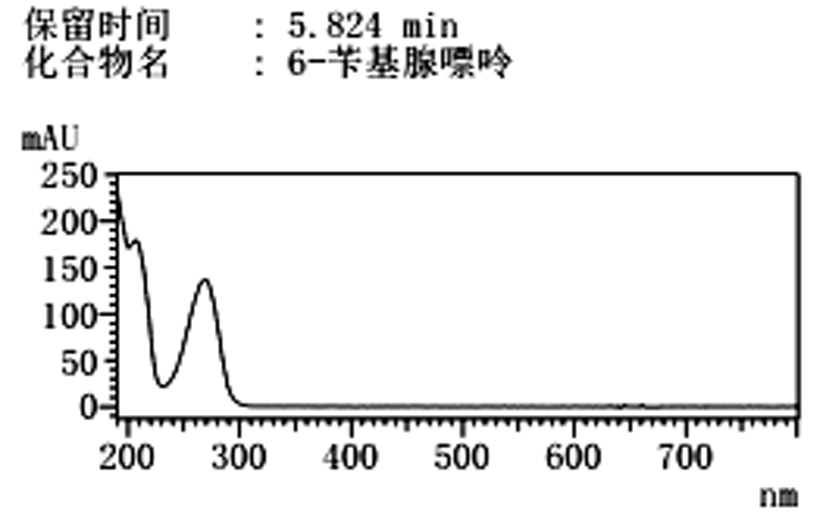
花生芽中6-苄基腺嘌呤的測定方法研究
-

多重PCR法在食品中致瀉大腸埃希氏菌質控考核中的應用
-
質量控製圖在實驗室質量控製中的應用
-
衍生反應在日常食品和飲用水檢測中的應用
-
高效液相串聯質譜法檢測辣椒油中的羅丹明B
-
國家市場監管總局關於5批次食品不合格情況的通告
-
對5種去除蔬菜中殘留有機磷農藥的 處理方法的效果分析
-
快速測定芝麻油含量方法的研究
-
2017年信陽市溮河區食藥監局食用農產品抽驗質量分析報告
-

動物源性食品鴨血中鴨成分普通PCR檢測方法探究
-

生活萬歲丨堅果怎麼吃明白?央視這個節目告訴你
-

總局重點實驗室評定專家委員會委員候選人信息公示
-
藥補不如食補,一張食品營養表告訴你,缺什麼吃什麼!
-
食品中多種違禁工業染料的同時檢測及應用
-
煙用膠中塑化劑GC-MS檢測方法的研究
-
茶葉中有機氯農藥P,P’-DDT 含量的檢測
-

安全美味金針菇,應該這樣選!這樣存!
-
一種反式脂肪酸的檢測方法
-
肉及肉製品中空腸彎曲菌的汙染情況調查
-

食品感官檢驗技術及其應用探討





