Veriflow與FDA和USDA方法對食品樣品中沙門氏菌檢測的比較
2017-09-15 14:33:17 來源:
□ 雷傑 上海美凱純生物科技有限公司
摘 要:Veriflow?檢測係統是一種基於分子生物學的測定方法,可準確檢測乳製品、肉製品、整雞淋洗液和即食食品中的沙門氏菌。該檢測方法將PCR檢測與快速、可視化的垂直流層析法相結合,不需要純化樣品、凝膠電泳或基於熒光素擴增目標菌,後期沒有複雜的數據分析過程。針對8個不同的食品和環境基質的檢測結果表明:對於含量極低的沙門氏菌(人工接種或自然存在),Veriflow沙門氏菌檢測(SS)都表現出很高的檢測靈敏度。通過對檢測結果陽性率的統計分析發現,Veriflow檢測結果與FDA微生物分析手冊BAM的方法和美國農業部世界杯赛程预测
與檢驗局微生物實驗室方法USDA/FSIS MLG的結果沒有顯著差異。包容性、排他性、性能穩定性等研究結果均表明Veriflow SS是一款穩定、可靠的產品,能高靈敏性、高選擇性、高包容性地檢測環境表麵、乳製品、肉、整雞淋洗液和各類即食食品中的沙門氏菌。關鍵詞:沙門氏菌屬 Veriflow 包容性 排他性 靈敏度
引言
致病菌帶給企業和消費者的危害不言而喻,各國政府和企業都對食源性致病菌的快速診斷寄予厚望,這也使各種檢測方法層出不窮。美國Veriflow DNA簽名捕獲技術的致病菌、腐敗菌檢測係統,以其快速、準確、可視化等特點在各種檢測方法中獨樹一幟,是一項具有創新性的分子檢測技術,即使在未經淨化處理的樣品基質中也能高靈敏、高精確的檢測目標菌。

Veriflow PCR擴增儀 分子層析卡盒 多光源定量儀(選配)
1.1 材料
a.標準菌株:性能穩定性和批間穩定性測試中陽性樣本和陰性樣本的培養物,分別采用鼠傷寒沙門氏菌(ATCC 14028)和枸櫞酸杆菌(ATCC 8090);包容性和排他性測試菌株分別采用104株不同血清型沙門氏菌菌株和35株非沙門氏菌。
b.樣品基質:生牛肉(20%的脂肪)、牛奶(2%的脂肪)、整雞淋洗液、熱狗。
1.2 Veriflow沙門氏菌(SS)檢測原理和檢測流程
Veriflow SS是一種基於PCR和DNA簽名捕獲技術的檢測方法,將PCR與DNA簽名探針和垂直層析流係統相結合,能夠提供特異的、高靈敏度的靶標分子簽名檢測和快速、易解的檢測結果。
本研究中,對各種基質進行采樣、增菌和PCR擴增,獲得沙門氏菌屬的特異性擴增產物。然後將PCR擴增產物直接滴加到層析卡盒的樣本視窗裏,再加入4滴緩衝液,僅需3分鍾即可產生反應信號。拉動檢測卡盒上的開關,觀察檢測結果。出現一條紅色質控線,表示層析卡盒工作正常。質控線和檢測線都出現表示沙門氏菌屬陽性,而隻出現質控線,則表示為陰性結果(如圖1所示)。
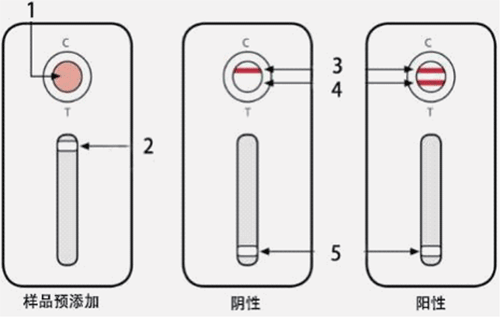
圖 1
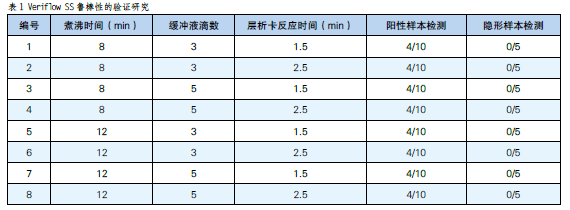
性能穩定性(魯棒性)驗證研究:目的是評估Veriflow SS PCR操作步驟中的微小改變(樣本煮沸時間、緩衝液滴加量或層析卡盒反應時間)是否能影響其檢測性能(如表1)。
1.4 Veriflow SS與FDA推薦沙門氏菌檢測方法對比
食品基質檢測方法比較:不同的食品基質接種不同血清型的沙門氏菌,食品基質的每個樣品中均加入稀釋24h的肉湯培養物,充分混合,在4℃下平衡48~72h。通過3種檢測濃度下的陽性樣品個數,來計算MPN。
整雞胴體檢測方法比較:實驗開始前兩批各20個樣本一直保存在4±2℃。每份樣本用400mL IS BPW進行淋洗,從每份雞肉淋洗液中各取36mL和30mL,分別用於Veriflow SS和FDA推薦方法檢測。
表3 Veriflow SS 和FDA參考方法食品基質(生肉,即食食品,乳製品和雞胴體)檢測POD結果
| 基質 | 菌株 | MPN/ 檢測 |
Veriflow SS | 參考方法 | ||||||
| nb | xc | PODCd | 95% Cle | x | PODRf | 95% Cl | PODC | |||
| 生牛肉 | S.Typhimurium ATCC 14028 |
_ | 5 | 0 | 0.00 | 0.00,0.43 | 0 | 0.00 | 0.00,0.43 | 0.00 |
| 0.11 | 20 | 15 | 0.75 | 0.53,0.89 | 15 | 0.75 | 0.53,0.89 | 0.00 | ||
| 0.34 | 5 | 5 | 1.00 | 0.57,1.00 | 5 | 1.00 | 0.57,1.00 | 0.00 | ||
| 熱狗 | S. Infantis ATCC 51741 |
_ | 5 | 0 | 0.00 | 0.00,0.43 | 0 | 0.00 | 0.00,0.43 | 0.00 |
| 0.58 | 20 | 9 | 0.45 | 0.26,0.66 | 9 | 0.45 | 0.26,0.66 | 0.00 | ||
| 4.38 | 5 | 5 | 1.00 | 0.57,1.00 | 5 | 1.00 | 0.57,1.00 | 0.00 | ||
| 牛奶 | S. Choleraesuis ATCC 10708 |
_ | 5 | 0 | 0.00 | 0.00,0.43 | 0 | 0.00 | 0.00,0.43 | 0.00 |
| 0.45 | 20 | 6 | 0.30 | 0.15,0.52 | 7 | 0.35 | 0.18,0.57 | -0.05 | ||
| 2.46 | 5 | 5 | 1.00 | 0.57,1.00 | 4 | 0.80 | 0.57,1.00 | 0.20 | ||
| 整雞淋洗液 | Naturally occurring |
Lot 1 | 20 | 4 | 0.20 | 0.08,0.42 | 5 | 0.25 | 0.11,0.47 | -0.05 |
| Lot 2 | 20 | 7 | 0.35 | 0.18,0.57 | 10 | 0.50 | 0.30,0.70 | -0.15 | ||
a.MPN=最大可能數,使用AOAC MPN計算方法統計參考方法檢測樣品的POD(陽性率)值;b.n=試驗數量;c.x=陽性樣本的數量;d.PODC:陽性結果除以總試驗次數得到的陽性率;e.Cl=置信區間;如果dPOD的CI不包含零,則該差異在5%的水平上具有統計學意義;f._=未接種樣品
2 結果與分析
2.1 性能穩定性和批次穩定性研究
性能穩定性實驗結果證明:操作步驟的變動不會影響Veriflow SS的測試性能。實驗結果符合AOAC-RI PTM要求的分數計算,且所有的陽性樣本都經FDA和USDA參考方法確認。這些結果表明,某些測試參數的變化不會直接影響Veriflow SS的測定性能。
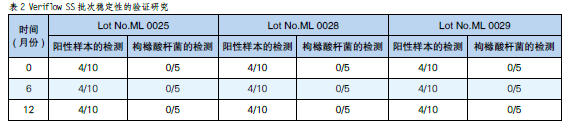
批次間穩定性實驗清晰地表明:3個批次的Veriflow SS不同使用時間點的測定性能都保持一致。同時,這些結果也說明Veriflow SS在12個月的使用期限間,均能保持穩定的測定性能。
2.2 包容性和排他性研究
該實驗結果表明:Veriflow SS能準確的檢測104株不同的沙門氏菌屬。與包容性結果一致,排他性研究結果也證明Veriflow SS能準確區分沙門氏菌屬和其他細菌。
2.3 食品基質檢測方法結果比較
食品基質檢測結果:3個不同接種水平的樣品,低濃度的檢測樣中,Veriflow SS檢測方法和FDA 參考方法陽性檢出率無顯著差異,所有的隻接種幹擾菌的樣本,通過兩種方法的檢測結果均為陰性,故兩種方法統計學上不存在顯著性差異。
整雞胴體檢測結果:基於POD統計分析,兩種方法不存在顯著性差異(陽性樣品均采用參考方法確認)。
3 討論和結論
上述檢測結果說明:與FDA和USDA參考方法相比,對於乳、肉、整雞和即食食品等8種基質中104種沙門氏菌的檢測,Veriflow SS與FDA和USDA參考方法的檢測結果無顯著差異,具有很好的特異性、準確性和可靠性。在整個試驗過程中,沒有出現假陽性和假陰性結果。與參考方法相比,Veriflow不需要複雜樣品製備,僅需18~24h就可以得到準確的檢測結果,大大短於參考方法3~4天的檢測時間。因此,本研究的結果表明:Veriflow沙門氏菌檢測係統是一種靈敏、可靠和簡單易操作的快速致病菌檢測方法。
參考文獻:
[1] U.S. Food and Drug Administration (2001) Bacteriological Analytical Manual, Ch. 5, “Salmonella,” https://www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm070149.htm.
熱點推薦
-

主要食品配料廠商攜手支持可持續農業
-

別樣肉客在華推出脆香酥炸植物基蟹餅,為新春佳節增添美食新選
-

ADM首度亮相FBIF2023,探索食品飲料的今天、明天和未來
-

專訪嬰兒水團體標準製定者:為何為嬰兒飲用水製定更高標準?
-

使用梅特勒-托利多X光機的五大理由
-
M-FASTTM(磁在快)沙門氏菌測試盒 在沙門氏菌檢驗中的應用研究
-
穩定過敏原檢測方法,規避食物過敏危險
-
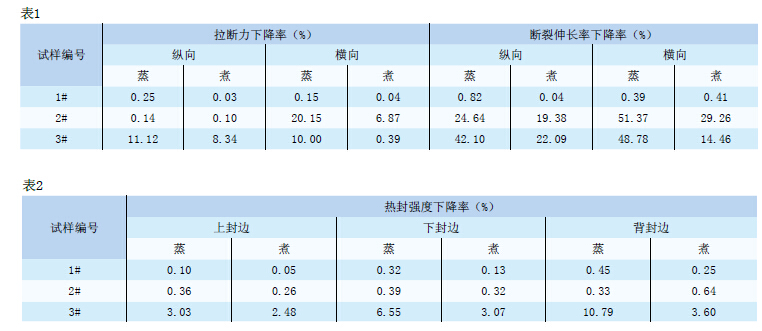
耐蒸煮包裝常見問題及檢測方法介紹
-
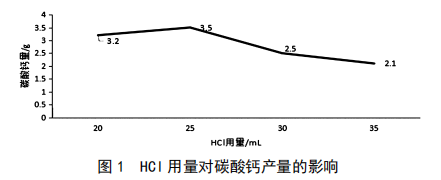
貝類食品級碳酸鈣製備的研究
-
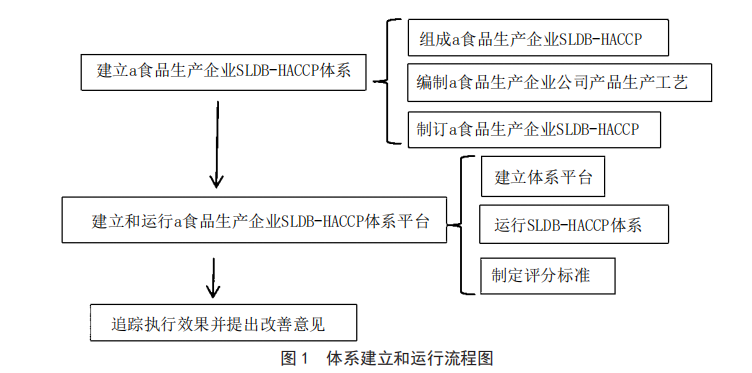
基於SLDB-HACCP體係的應用及成效分析——以a食品生產企業為例
-

基層世界杯赛程预测 預警體係存在問題及對策分析
-
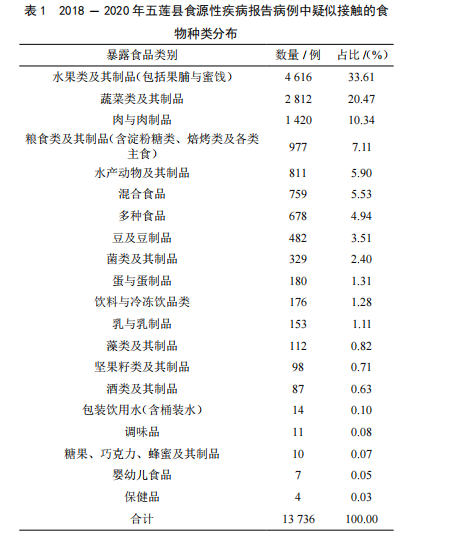
2018-2020年五蓮縣食源性疾病監測結果分析
-
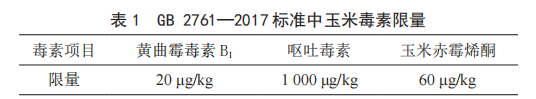
玉米中真菌毒素汙染情況分析
-

2015—2020年中國家庭食物中毒2022世界杯预选赛最新排名 報道中科普情況調查分析
-
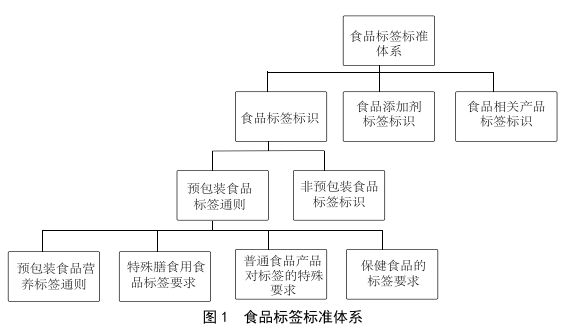
預包裝食品標簽中常見問題及對策
-
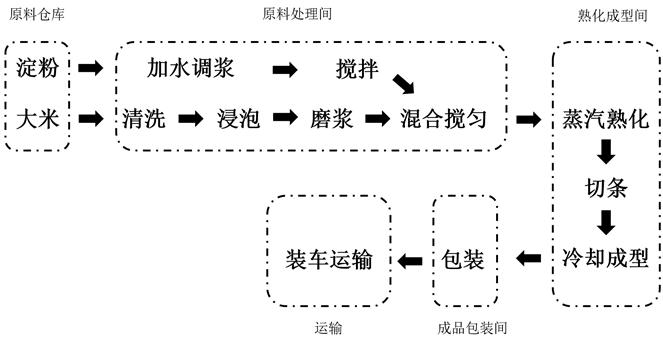
濕河粉生產加工過程中蠟樣芽孢杆菌汙染情況調查分析
-

探索新型海洋活性脂質研究成果,傳遞“她”力量
-

植物肉產業蓬勃發展,關鍵技術創新可助力企業實現“彎道超車”
-

用技術賦能食品供應鏈變革,助力提升消費者的世界杯赛程预测 信任度
-

“從農場到餐桌”的解決方案組合,滿足食品供應鏈的透明度需求
-

北京市綠色食品產業發展特征與影響因素分析
-

采用快速顯色培養基檢測蠟樣芽孢杆菌更具優勢
-

鳴 謝
-

THE NEXT GENERATION! 莫迪維克TX係列領航數字化托盒包裝新時代
-

莫迪維克托盒封口包裝機 T 300 L: 全新尺寸、更高產能、更廣適用度
-
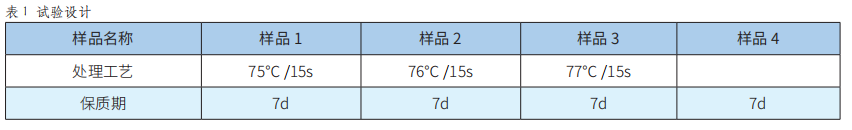
加工工藝對乳中生物活性物質的影響初探
-
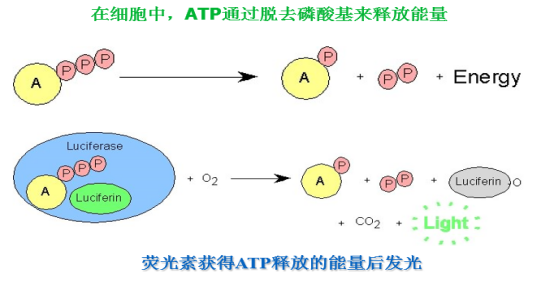
探究ATP檢測方法在牧場衛生管控中的應用
-
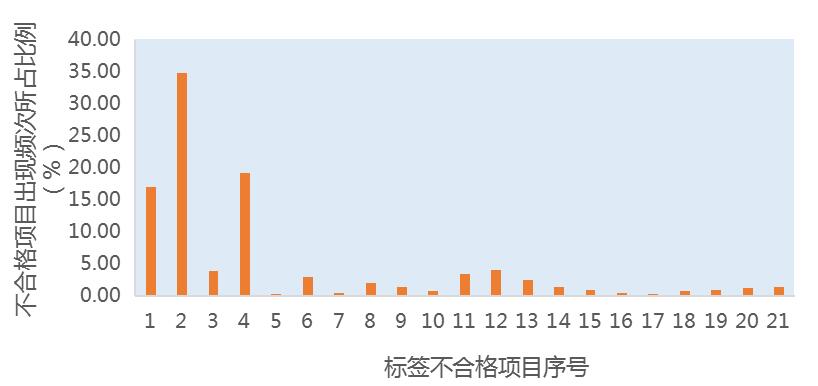
預包裝食品標簽中常見問題淺析
-

你的瓶裝水真的是發黴了嗎?
-
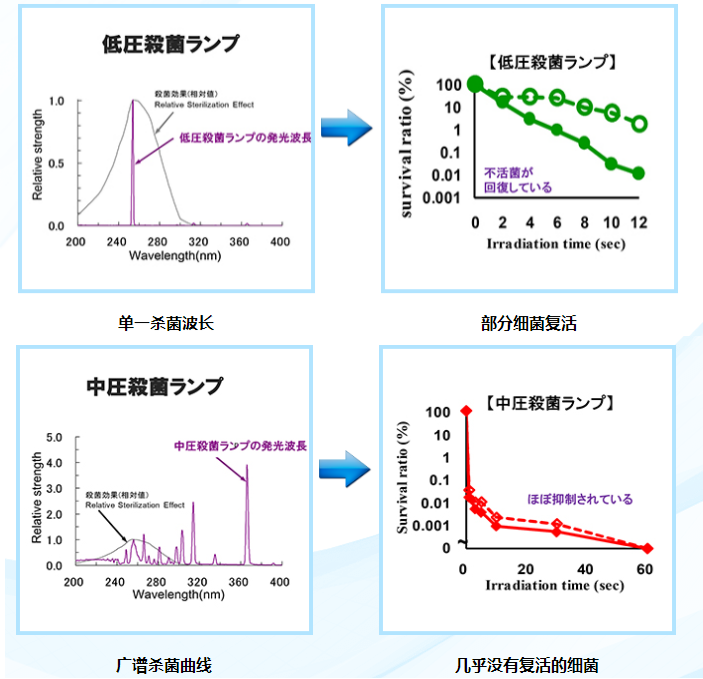
中壓紫外線技術在包裝飲用水中的殺菌應用
-

瓶胚幹法殺菌技術在飲用天然礦泉水生產中的應用
-
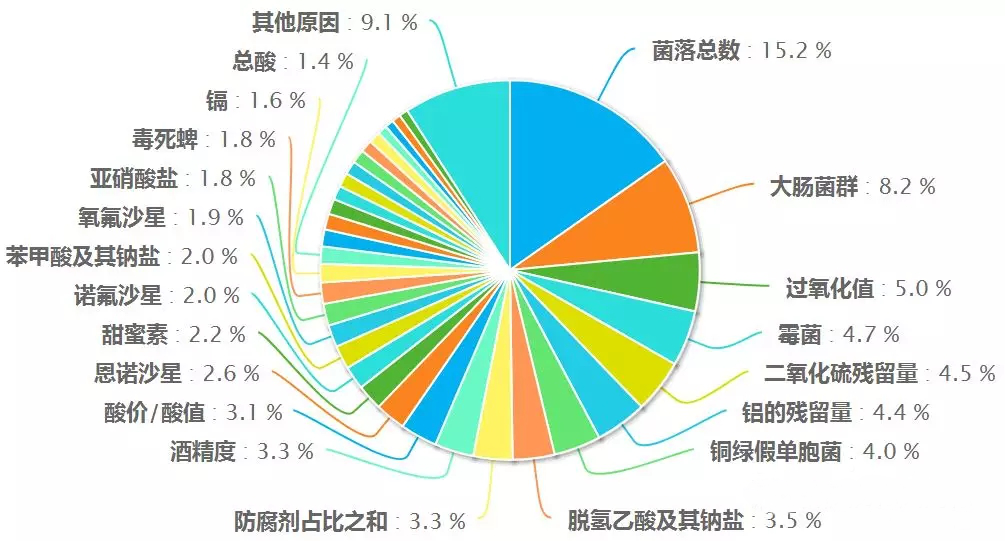
如何避免產品過氧化值超標
-
響應麵優化馬鮫魚魚皮膠原蛋白的提取工藝





